-
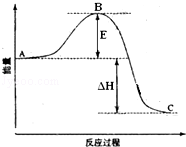
下列反应属于吸热反应的是
A.C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
B.CH3COOH+KOH⇌CH3COOK+H2O
C.反应物的总能量大于生成物的总能量
D.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
难度: 中等查看答案及解析
-
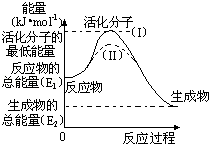
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,不能改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化不一定伴随着能量变化
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g)═H2(g)+
O2(g)△H=+241.8kJ/mol
H2(g)+
O2(g)═H2O(1)△H=﹣285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热44kJ B.吸热2.44KJ C.放热44kJ D.放热2.44KJ
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)═2HF(g)△H=﹣270kJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
难度: 中等查看答案及解析
-
在一定条件下A与B反应可生成C和D,其能量变化如图:
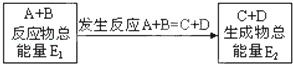
下列有关反应A+B═C+D的说法正确的是
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJ/mol
2H2(g)+O2(g)═2H2O(g)△H2=﹣Q2 kJ/mol
2H2(g)+O2(g)═2H2O(l)△H3=﹣Q3 kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是
A.放出的热量为(0.4Q1+0.05Q3)kJ/mol
B.放出的热量为(0.4Q1+0.05Q2)kJ/mol
C.△H2>△H3
D.△H2<△H3
难度: 中等查看答案及解析
-
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)═2H2O(l)△H1=﹣Q1 kJ•mol﹣1
(2)2H2(g)+O2(g)═2H2O(l)△H1=﹣Q2 kJ•mol﹣1
(3)2H2(l)+O2(g)═2H2O(g)△H1=﹣Q3 kJ•mol﹣1
则Q1、Q2、Q3的关系表示正确的是
A.Q1=Q2<Q3 B.Q2>Q1>Q3 C.Q3>Q2>Q1 D.Q1=Q2=Q3
难度: 中等查看答案及解析
-
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是
A.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=﹣57.3kJ/mol
B.KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol
C.C8H18(l)+
O2 (g)=8CO2 (g)+9H2O(g)△H=﹣5518 kJ/mol
D.2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=﹣11036 kJ/mol
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+
△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为566 kJ/mol
B.如图可表示由CO生成CO2的反应过程和能量关系
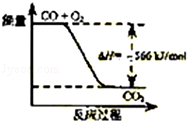
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA
难度: 困难查看答案及解析
-
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是
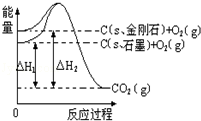
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJ•mol﹣1
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性强于金刚石
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 中等查看答案及解析