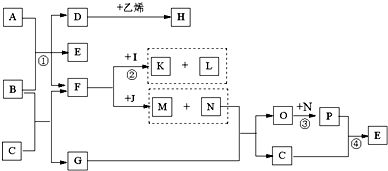
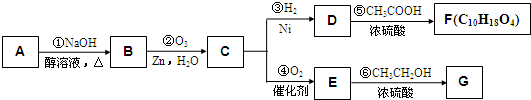
-
R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R、M的最高价氧化物水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和过量氢氧化钙溶液混合:HCO3-+OH-+Ca2+=CaCO3↓+H2O
B.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
C.往碳酸镁中滴加足量的稀盐酸:CO32-+2H+=CO2↑+H2O
D.苯酚钠溶液与少量二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-难度: 中等查看答案及解析
-
下列描述中,不符合化学科学的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
B.加新制的Cu(OH)2并加热可检验尿液中的葡萄糖
C.气体甲通入溶液乙中时,随甲的通入,溶液乙的颜色逐渐褪去,说明气体甲一定有漂白性
D.室温碱性条件下,在淀粉与碘水的混合溶液中滴加FeCl2溶液,混合液的蓝色迅速褪去,并产生红褐色沉淀,说明氧化性(碱性条件下):I2>Fe(OH)3难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.将5.6克铁投入一定量的硝酸中,转移电子数为0.3NA
B.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
C.1.72g生石膏 转化为熟石膏 失去的结晶水数目为0.015NA
D.1 mol冰中,氢键的数目是NA难度: 中等查看答案及解析
-
据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1mol O2(PtF6)则转移1mol电子
D.在O2(PtF6)中不存在共价键难度: 中等查看答案及解析
-
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后两个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( )
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同难度: 中等查看答案及解析
-
对于反应N2O4(g)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
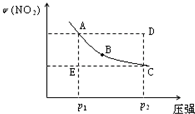
A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1难度: 中等查看答案及解析
-
聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性.如图是我国化学家近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基).
下列关于上述高分子的说法不正确的是( )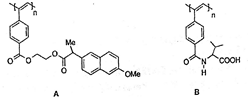
A.A和B均能在一定条件下水解,且水解形成相同的高分子
B.A水解所得的药物小分子羧酸的分子式为C14H14O3
C.B水解所得的小分子是一种α-氨基酸
D.A和B各1mol与热碱液反应,均最多消耗2molNaOH难度: 中等查看答案及解析