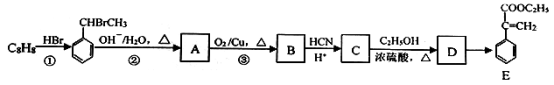
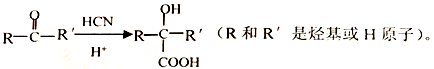-
化学与生活、社会发展息息相关。下列说法正确的是
A. “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
B. 汽车远程灯照在前方扬尘上有光亮的通路,说明混有扬尘的空气属于胶体
C. 废旧电池的回收处理,其主要目的是为了回收其中的金属
D. 蛋白质是仅由C、H、O元素组成的物质
难度: 中等查看答案及解析
-
下列物质与类别不对应的是
A
B
C
D
物质
小苏打
食用油
淀粉
84消毒液
类别
碱
油脂(酯类)
天然高分子化合物
混合物
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知反应:FeO·Cr2O3+Na2CO3+NaNO3
Na2CrO4+Fe2O3+CO2+NaNO2 (未配平)。下列说法正确的是
A. Na2CrO4是还原产物 B. 该反应中有3种元素的化合价发生变化
C. NaNO3是还原剂 D. 1 mol FeO·Cr2O3参与反应将得到7 mol电子
难度: 困难查看答案及解析
-
下列说法正确的是
A. 方程式2C+SiO2
2CO+Si表明非金属性:碳>硅
B. 一定量的氯气与过量的铁粉在密闭容器中充分反应,有FeCl2生成
C. 将少量的浓硝酸滴入盛有过量的铜粉的试管中,气体产物只有NO2
D. 向新制备的饱和氯水中加入碳酸钙粉末可以增强氯水的漂白性
难度: 困难查看答案及解析
-
下列解释事实的方程式不正确的是
A. 用湿润的淀粉—KI试纸检验Cl2: Cl2+2I-= 2 Cl-+I2
B. 工业固氮:N2+3H2
2NH3
C. 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D. 铝热法焊接铁轨:2Fe+Al2O3
2Al+Fe2O3
难度: 中等查看答案及解析
-
己知:①CO的结构式为C
O;②298K时相关化学键的键能数据如下表:
化学键
H—H
O—H
C—H
C
O
E/(KJ·mol-1)
436
465
413
1076
则反应 CO(g)+3H2(g)
CH4(g)+H2O(g)的△H的值为
A. -198kJ·mol-1 B. +267 kJ·mol-1 C. -298 kJ·mol-1 D. +634 kJ·mol-1
难度: 中等查看答案及解析
-
下列有关工业生产的叙述正确的是
A. 反应2SO2+O2
2SO3使用催化剂可以提高SO2的转化率
B. 电解法精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量小
C. 合成氨工业中,通常将液态氨及时分离出去以加快化学反应速率
D. 工业上通常采用电解饱和食盐水的方法制备金属钠
难度: 中等查看答案及解析
-
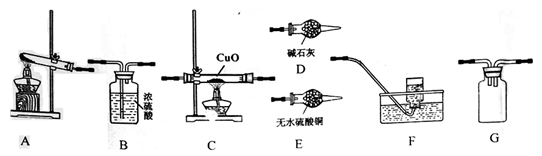
用下列装置进行的实验,不能达到相应实验目的的是
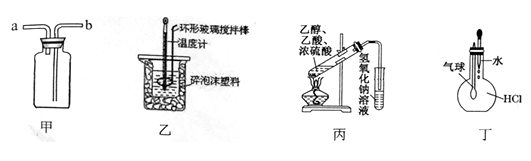
A. 装置甲:气体从a口进入,收集NH3 B. 装置乙:实验室测定中和热
C. 装置丙:实验室制取并收集乙酸乙酯 D. 装置丁:验证HCl气体易溶于水
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,Y元素原子次外层电子数等于其最外层电子数的2倍。下列判断错误的是
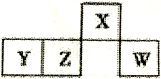
A. r(w)>r(z)>r(y)>r(x) B. 最简单气态氢化物的沸点:X>W
C. Y元素的最高价氧化物能与强碱反应 D. W的最髙价氧化物对应的水化物属于一元强酸
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,30克的C2H6含有的共价键数为6NA
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L单质溴所含原子数为2NA
D. 25℃时,pH=l的H2SO4溶液中的H+数目为0.2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙烯、聚乙稀和苯分子中均含有碳碳双键
B. 纤维素可以被人体消化吸收,因为它在人体内可以水解成葡萄糖
C. 石油裂解、煤的干馏、玉米酿酒、紫外线消毒等过程都有化学变化发生
D. 乙烯使溴水褪色与乙烯使酸性KMnO4溶液褪色的原理相同
难度: 中等查看答案及解析
-
下列离子方程式,正确的是
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 将铜片插入硝酸银溶液中:Ag++Cu = Cu2++Ag
C. 氢氧化镁与稀盐酸混合OH-+H+=H2O
D. 向浓NaOH溶液中滴入几滴氯化铵溶液并加热:NH4++OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
在一定温度下,将气体X和Y各3 mol充入10 L恒容密闭容器中,发生反应:3X(g)+Y(g)
2Z(g)+ W(g)。经过8min,反应达到平衡状态,此时Z的物质的量为1.6 mol。下列关于反应开始至第8 min时的平均反应速率的计算正确的是
A. v(X)=0.30 mol/(L·min) B. v(Y)=0.02 mol/(L·min)
C. v(Z)=0.02 mol/(L·min) D. v(W)=0.10 mol/(L·min)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 某物质的溶解性为难溶,则该物质不溶于水
B. H2S为二元弱酸,其电离方程式为:H2S
2H++S2-
C. 已知:常温下,AgCl的Ksp=1.8×10-10。向99mL 0.01 mol/L KCl溶液中,加入lmL 0.01mol/LAgNO3溶液(忽略混合时溶液体积的变化),立即产生白色沉淀
D. NaHCO3溶于水会水解,该水解反应可表示为:HCO3-+H2O
H3O++CO32-
难度: 困难查看答案及解析
-
锌—空气电池是金属空气电池的一种,电解质溶液为KOH溶液时,反应为:2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是

A. 石墨电极上发生氧化反应 B. 正极附近溶液的pH不断减小
C. OH-由锌电极移向石墨电极 D. Zn 电极上发生反应:Zn-2e-+4OH-=Zn(OH)42-
难度: 困难查看答案及解析
-
将mg镁铝合金投入到500 mL 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L (标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为( )
A. 5.10 B. 8.50
C. 9.35 D. 11.48
难度: 困难查看答案及解析


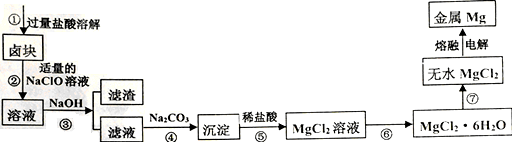
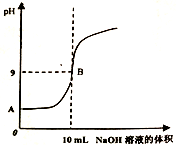
 与对羟基苯甲酸
与对羟基苯甲酸 的沸点相差较大,根据结构分析,前者的沸点_________后者(填“髙于”或“低于”)并解释原因___________________。
的沸点相差较大,根据结构分析,前者的沸点_________后者(填“髙于”或“低于”)并解释原因___________________。