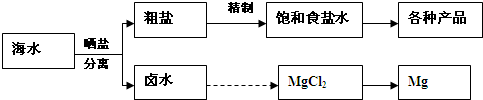
-
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙作电极组成原电池时,甲是负极难度: 中等查看答案及解析
-
可以将反应Zn+Br2=ZnBr2设计成可充电电池,下列4个电极反应①Br2+2e-=2Br- ②2Br--2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③
B.②和①
C.③和①
D.④和①难度: 中等查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快难度: 中等查看答案及解析
-
用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)难度: 中等查看答案及解析
-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A.阴极
B.阳极
C.正极
D.负极难度: 中等查看答案及解析
-
在1mol/L的下列物质的溶液中,水的电离程度最大的是( )
A.Na2CO3
B.NaHCO3
C.NaCl
D.NaHSO4难度: 中等查看答案及解析
-
pH=3的盐酸与pH=13 氢氧化钠溶液等体积混合后,所得溶液的pH约为( )
A.3.3
B.7
C.8
D.12.7难度: 中等查看答案及解析
-
下列中和滴定操作会导致测量结果明显偏高的是( )
A.用甲基橙作指示剂,标准盐酸滴定待测氢氧化钠溶液至溶液由黄色刚好变橙色
B.用酚酞作指示剂,标准盐酸滴定待测氢氧化钠溶液至终点时,酸式滴定管尖出现气泡
C.用甲基橙作指示剂,标准氢氧化钠溶液滴定待测醋酸溶液至溶液由红色刚好变橙色
D.用酚酞作指示剂,标准盐酸滴定待测氨水溶液至溶液由红色刚好变无色难度: 中等查看答案及解析
-
相同物质的量浓度的下列化合物的水溶液,按PH减小顺序排列是( )
A.NaHSO4 CH3COONa NH4Cl NaNO3
B.NaNO3 CH3COONa NaHSO4 NH4Cl
C.CH3COONa NaNO3 NH4Cl NaHSO4
D.NaNO3 CH3COONa NH4Cl NaHSO4难度: 中等查看答案及解析
-
在蒸发皿中用酒精灯加热并灼烧下列物质的溶液,可以得到该物质固体的是( )
A.氯化铝
B.碳酸氢钠
C.硫酸镁
D.高锰酸钾难度: 中等查看答案及解析
-
在10mL0.1mol/LNaOH溶液中加入20mL0.1mol/L的HAc溶液,所得溶液的pH<7,反应后溶液中各微粒的浓度关系正确的是( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH- )
B.c(Na+)>c(Ac-)>c(OH-)>c(H+)
C.c(Na+)=c(Ac-)+c(HAc)
D.c(Na+)+c(H+)=c(Ac-)+c(OH-)难度: 中等查看答案及解析
-
将少量碳酸镁粉末加入水中,通入足量的CO2气体后,粉末完全溶解,生成了碳酸氢镁,再加热,溶液又变浑浊,生成氢氧化镁沉淀和CO2气体.上述转化过程中,没有发生的平衡移动是( )
A.溶解平衡
B.电离平衡
C.水解反应化学平衡
D.氧化还原反应化学平衡难度: 中等查看答案及解析
-
如图所示,4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )

A.①<②<③<④
B.②<①<③<④
C.②<①<④<③
D.①<②<④<③难度: 中等查看答案及解析
-
右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是( )
a极板 b极板 X电极 电解质溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )

A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e-═2H2O
D.该装置中a极为正极,发生氧化反应难度: 中等查看答案及解析
-
铁锈的成分中含有铁的氧化物、铁的氢氧化物.研究证明,铁器的生锈与大气中的氧气、水蒸气有关.下列做法中最有利于减缓铁器生锈的是( )
A.铁锅用完后用水刷洗干净其表面的油垢
B.久置不用的铁刀涂凡士林在空气中保存
C.将铁壶盛水后保存
D.铁勺、铁铲放在阴湿处保存难度: 中等查看答案及解析
-
如图所示,下列叙述正确的是( )
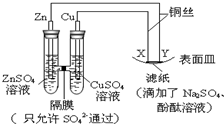
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红难度: 中等查看答案及解析
-
下列有关金属的说法正确的是( )
A.银器在空气中变暗后,放入盛有盐水的铝容器中,变质银器能被还原又会变光亮
B.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.不锈钢不生锈是因为表面有保护膜
D.D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀难度: 中等查看答案及解析
-
有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1难度: 中等查看答案及解析
-
复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验.滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹.据此判断电极材料与反应现象均正确的是
( )滤纸混合溶液 d极反应产物 阴极反应产物 字体颜色 ① 氯化钠、无色酚酞 Fe2+ 氢气 红色 ② 碘化钾、淀粉 Cu2+ 氢气 紫色 ③ 硫酸钠、无色酚酞 Fe2+ 氧气 红色 ④ 碘化钾、淀粉 Cu2+ 氢气 蓝色 
A.①②
B.①④
C.②③
D.③④难度: 中等查看答案及解析
-
关于如图所示装置的叙述正确的是( )

A.甲乙装置中的锌片都做负极
B.甲乙装置中的溶液内的H+在铜片上被还原
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片上有气泡生成,乙装置中铜片质量减小难度: 中等查看答案及解析
-
据报道,某海军航空站安装了一台250kW的MCFC型的燃料电池.该电池不仅能为航空站提供电能,同时还供应水蒸气,其工作温度为600~700℃,所用的燃料是H2,电解质是熔融的K2CO3.已知该电池的总反应式为:2H2+O2═2H2O,正极的电极反应是:O2+4e-+2CO2═2CO32-,则下列说法正确的是( )
A.放电时,负极反应为:H2-2e-═2H+
B.电池工作时,电解质中的CO32-移向电池的负极
C.该燃料电池供应1 mol水蒸气时转移电子的物质的量为4 mol
D.放电过程中,电池中的Na2CO3的物质的量逐渐增大难度: 中等查看答案及解析
-
关于下图所示各装置的叙述中,正确的是( )
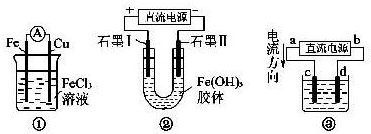
A.装置①为原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++e-═Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液难度: 中等查看答案及解析
-
将0.1L含有0.02mol CuSO4和0.01mol NaCl的水溶液用惰性电极电解.电解一段时间后,某电极的质量增加了0.64g.下列说法正确的是( )
A.质量增加的电极为阳极
B.电解过程中电子转移数为0.02NA
C.电解过程中某电极上只有Cl2产生
D.电解过程中pH增大难度: 中等查看答案及解析
-
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
A.CuSO4
B.Na2SO4
C.CuCl2
D.NaCl难度: 中等查看答案及解析
-
下面有关电化学的图示,完全正确的是( )
A.
Cu-Zn原电池
B.
粗铜的精炼
C.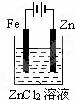
铁片镀锌
D.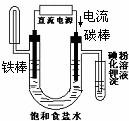
验证NaCl溶液(含酚酞)电解产物难度: 中等查看答案及解析
-
获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
A.该电池负极的电极反应为:Al-3e-═Al3+
B.电池工作时,溶液中的铝离子向正极移动
C.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多
D.该电池可能是一种可充电的二次电池难度: 中等查看答案及解析
-
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50mL,当阴极析出9.6g固体时,标准状况下阳极得到的气体的体积是( )
A.3.36 L
B.2.8 L
C.6.72 L
D.4.48 L难度: 中等查看答案及解析