-
保护环境,就是关爱自己.下列说法中你认为不正确的是
A.空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物
B.酸雨属空气污染,是指pH小于7的雨水,主要是人为的向大气中排放大量酸性物质造成的
C.为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须回收处理
D.氯气是一种黄绿色、有毒气体,但可以用于自来水的杀菌消毒
难度: 中等查看答案及解析
-
下列物质属于离子化合物且含有共价键的是
A.KOH B.MgCl2 C.HCl D.N2
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.40K和40Ca原子中的质子数和中子数都不相等
B.金刚石和石墨的性质相同
C.H2和D2互为同位素
D.某物质中只含一种元素,该物质一定是纯净物
难度: 中等查看答案及解析
-
两种微粒的质子数和电子数都相等,它们不可能是( )
A.一种阳离子和一种阴离子 B.一种单质分子和一种化合物分子
C.两种原子 D.一种原子和一种分子
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中不正确的是( )。
A.锂(Li)与水反应比钠与水反应剧烈
B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D.HBrO4的酸性比HIO4的酸性强
难度: 中等查看答案及解析
-
下列说法错误的是
A.液氨汽化时要吸收大量的热,常用作制冷剂
B.压减燃煤、严格控车、调整产业是治理雾霾的有效措施
C.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料
D.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀
难度: 中等查看答案及解析
-
下列有关酸雨的说法不正确的是( )
A.在酸雨形成过程中没有发生氧化还原反应
B.二氧化硫、二氧化氮是形成酸雨的主要因素
C.煤和石油的燃烧、汽车尾气等是酸雨污染物的主要来源
D.酸雨的危害有破坏农作物,使土壤、湖泊酸化以及加速建筑物、桥梁的腐蚀等
难度: 中等查看答案及解析
-
某课外学习小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,先慢慢通入O2,一段时间后,再喷射蒸馏水即得硫酸型酸雨.则关于NO的作用说法正确的是
A.还原剂 B.氧化剂 C.反应物 D.催化剂
难度: 简单查看答案及解析
-
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
①铊是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+强
④单质能和稀硝酸反应生成硝酸盐
A.①④ B.②③ C.① D.④
难度: 中等查看答案及解析
-
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是
A.NaH的电子式为Na+[:H]-
B.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C.微粒半径H-<Li+
D.NaH与H2O反应时,水作氧化剂。
难度: 中等查看答案及解析
-
已知 X+、 Y2+、 Z-、 W2-四种离子均具有相同的电子层结构。下列关于 X、Y、Z、W 四种元素的描述,不正确的是
A.原子半径: X>Y>W>Z B.原子序数: Y>X>Z>W
C.原子最外层电子数: Y>X>Z>W D.金属性: X>Y ,还原性:W2->Z-
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、R的原子序数依次增大,其中前四种元素原子的最外层电子数之和为14。X是周期表中原子半径最小的元素,Z是短周期中金属性最强的元素,Y与W原子序数相差8。下列说法不正确的是
A.原子半径:X<W<Z
B.最高价氧化物对应水化物的酸性:W>R
C.简单气态氢化物的热稳定性:Y>W
D.Y在周期表中的位置为第二周期ⅥA族
难度: 中等查看答案及解析
-
几种短周期元素的原子半径和主要化合价见表:
元素代号
X
Y
Z
L
M
Q
原子半径/nm
0.160
0.143
0.102
0.099
0.077
0.074
主要化合价
+2
+3
+6、-2
+7、-1
+4、-4
-2
下列说法正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
难度: 中等查看答案及解析
-
给盛有氯化钡稀溶液的甲、乙两支试管中分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
难度: 中等查看答案及解析
-
下图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次增大的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成的化合物的稳定性高于Z的其他同族元素与X形成的化合物的稳定性
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
难度: 中等查看答案及解析
-
下列实验操作能够达到实验目的是
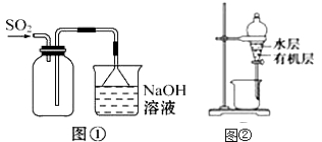
A.实验室采用图①所示装置收集SO2
B.用图②所示装置,分离CCl4萃取I2水后的有机层和水层
C.除去NaHCO3溶液中的Na2CO3可加入Ca(OH) 2溶液后过滤
D.称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液
难度: 中等查看答案及解析
-
下列有关离子检验的叙述正确的是
A.向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,产生白色沉淀,则原溶液中一定有SO42
B.向某溶液中加入稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀,则原溶液中一定有Cl
C.向某溶液中加入碳酸钠溶液,产生白色沉淀,再滴入稀盐酸,沉淀溶解,则原溶液中一定有Ca2+
D.用光洁的铂丝蘸取某无色溶液,在酒精灯外焰里灼烧时观察到黄色火焰,则原溶液中一定有Na+
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是
A.三种元素的最高正化合价中,Z的最大
B.W晶体中只存在有共价键
C.原子半径:X>Y>Z
D.Y的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;
②铜与浓硝酸反应;
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述不正确的是
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量是①>②>③
C.途径③的制备方法最符合“绿色化学”理念
D.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3:2
难度: 中等查看答案及解析
-
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
A.将样品配制成溶液V1 L,取其中25.00mL恰好与V2 mL浓度为cmol/L酸性KMnO4溶液完全反应
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g
难度: 中等查看答案及解析
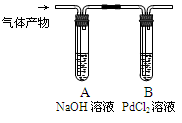

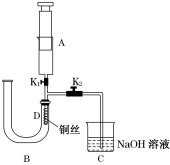
 (加热及夹持仪器省略)
(加热及夹持仪器省略)