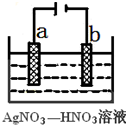
-
下列物质的水溶液能导电,但属于非电解质的是
A.CH3COOH B.Cl2 C.(NH4)2CO3 D.SO2
难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L•s),则2s末NH3的浓度为( )
A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L
难度: 中等查看答案及解析
-
室温下,对于0.10mol•L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应离子方程式为:Al3++3OH-=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)•c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液pH=13
难度: 中等查看答案及解析
-
可以将反应Zn+Br2═ZnBr2设计成蓄电池,下列4个电极反应其中表示放电时的负极反应和充电时的阳极反应的分别是( )
①Br2+2e-=2Br- ②2Br--2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn.
A.③和② B.①和② C.①和③ D.①和④
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置于低温处
B.在FeCl2溶液中加入铁粉防止氧化变质
C.生产硫酸中使用过量空气以提高二氧化硫的利用率
D.实验室用排饱和食盐水法收集氯气
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:
碳的燃烧热△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b
难度: 困难查看答案及解析
-
在pH=1的无色溶液中,下列离子能大量共存的是
A.NH4+、Ba2+、NO3- 、CO32- B.Fe2+、OH-、SO42-、MnO4-
C.Na+、Fe3+、Cl-、AlO2- D.K+、Mg2+、NO3-、SO42-
难度: 中等查看答案及解析
-
设C+CO
2CO;(正反应为吸热反应;反应速率为v1),N2+3H2
2NH3;(正反应为放热反应;反应速率为v2),当温度升高时,v1和 v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
向稀氨水中加入下列物质,能使溶液中能使溶液中的铵根离子浓度减小、pH增大的是( )
A.水 B.氨气
C.氢氧化钠固体 D.氯化铵固体
难度: 中等查看答案及解析
-
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是( )
A.平衡向正反应方向移动 B.(a+b)<(c+d)
C.Z的体积分数变小 D.X的转化率变大
难度: 困难查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.N3¯与CO2含相等电子数
B.HN3与NH3作用生成的产物是共价化合物
C.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
D.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
难度: 困难查看答案及解析
-
在一定温度下,反应
H2(g)+
X2(g)
HX(g)的平衡常数为10,若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5% B.17% C.25% D.33%
难度: 困难查看答案及解析
-
下列各变化中属于原电池反应的是
A.锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快
B.红热的铁丝与冷水接触,表面表成蓝黑色保护层
C.镀锌铁表面锌有划损时,仍然能阻止铁被氧化
D.在空气中金属铝表面迅速氧化形成保护层
难度: 中等查看答案及解析
-
根据右边两幅图,可判断出下列离子方程式中错误的是( )
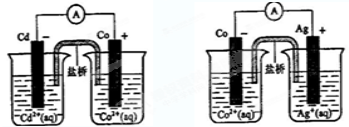
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd 2+(aq)
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
难度: 困难查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
反应时间/min
n(CO)/mol
H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•mim-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
难度: 困难查看答案及解析
-
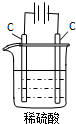
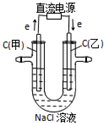
下列说法不正确的是通电一段时间后
A
B
C
D
通电一段时间后,搅拌均匀,溶液的pH增大
甲电极上的电极反应为:
2Cl--2e-═Cl2↑
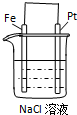
Pt电极上的电极反应为:
O2+2H2O+4e-═4OH-
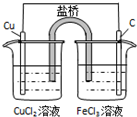
总反应的离子方程式为:
2Fe3++Cu═Cu2++2Fe2+
难度: 困难查看答案及解析