-
2008年1月8日,国家主席胡锦涛在人民大会堂为获得2007年国家最高科学技术奖的石油化工催化剂专家闵恩泽教授颁奖,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说法正确的是
A.使用催化剂可以增大正反应速率,减小逆反应速率
B.使用催化剂可以使化学平衡正向移动
C.使用催化剂可以降低反应的活化能
D.使用催化剂可以改变反应的平衡常数
难度: 中等查看答案及解析
-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做
A.正极 B.负极 C.阳极 D.阴极
难度: 简单查看答案及解析
-
在一定条件下,对于A2(g)+3B2(g)
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是
A.v(A2)=0.8mol·L-1·s-1 B.v(A2)=60mol·L-1·min-1
C.v(AB3)=1.0mol·L-1·s-1 D.v(B2)=1.2mol·L-1·s-1
难度: 中等查看答案及解析
-
正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明
A.碳酸、酒石酸都不是强酸
B.对人而言,酒石酸是必需的营养品
C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感
D.酒石酸钠水解显酸性
难度: 中等查看答案及解析
-
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
难度: 中等查看答案及解析
-
下列有关水的电离的说法正确的是
A.将水加热,KW增大,pH不变
B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大
C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小
D.向水中加入少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大
难度: 中等查看答案及解析
-
在容积不变的密闭容器中发生反应2NO2
2NO+O2,能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③v(NO2)∶v(NO)∶v(O2)=2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑥ B.②③⑤ C.①③④ D.④⑤⑥
难度: 中等查看答案及解析
-
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是

A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
难度: 中等查看答案及解析
-
已知镁粉与冷水几乎不反应,与热水反应缓慢。市场上购买的“即热饭盒”底部有两层,一层装水,另一层是镁粉与铁粉的混合物,当水与金属粉末接触时会发生反应Mg+2H2O=Mg(OH)2+H2↑。则下列说法不正确的是
A.“即热饭盒”的工作原理是将化学能转化为热能
B.上述反应中,反应物的总焓大于生成物的总焓
C.铁粉的作用是催化剂
D.上述反应的反应热Q为正值
难度: 中等查看答案及解析
-
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g)
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
蒸干并灼烧下列物质的水溶液,仍能得到该物质的是
A.氯化铝 B.碳酸氢钠 C.硫酸亚铁 D.碳酸钠
难度: 中等查看答案及解析
-
已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量。下列判断正确的是
A.白磷在氧气中燃烧的热化学方程式是:P4(s)+5O2(g)=P4O10(s) ΔH=-745.8kJ·mol-1
B.红磷转化成白磷时放出热量
C.红磷比白磷稳定
D.31g红磷中蕴含的能量为738.5kJ
难度: 中等查看答案及解析
-
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法不正确的是
A.浓度均为0.1mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1mol·L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中[F-]变小
难度: 困难查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是
A.电池工作时,MnO2发生还原反应
B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH-
C.电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g
D.电池工作时,K+移向负极
难度: 困难查看答案及解析
-
下图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
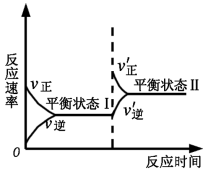
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
难度: 中等查看答案及解析
-
常温下,关于溶液的稀释说法正确的是
A.将1 L 0.1mol·L-1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol·L-1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
难度: 中等查看答案及解析
-
下列各种溶液中,可能大量共存的离子组是
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32-
C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3-
D.c(H+)=10-14mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-
难度: 中等查看答案及解析
-
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=1g
。则下列叙述不正确的是
A.中性溶液的AG=0
B.碱性溶液的AG>0
C.AG越大碱性越强,酸性越弱
D.常温下0.1mol·L-1氢氧化钠溶液的AG=-12
难度: 中等查看答案及解析
-
下列事实,不能用平衡移动原理解释的是
A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率
B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C.选择合适的催化剂可使水在较低温度下分解
D.滴有酚酞的CH3COONa溶液,加热后颜色变深
难度: 中等查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
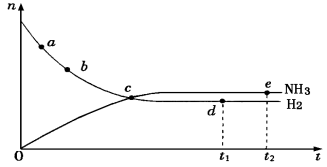
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
难度: 困难查看答案及解析