-
化学知识广泛应用于生产、生活中,下列叙述正确的是
A.空气中的臭氧对人体健康有益无害
B.液氯罐泄漏时,可将其移入水塘中并加入生石灰
C.由石英制取单晶硅的过程中,不涉及氧化还原反应
D.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2 B. CO2和H2O C.NaCl和HCl D.Na2O2和H2O2
难度: 中等查看答案及解析
-
已知反应:①2C(s)+O2(g)=2CO(g)△H=一221 kJ/mol
②H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol(稀溶液)
下列结论正确的是
A.碳的燃烧热为110.5 kJ/mol
B.1mol碳充分燃烧放出的热量大于110.5kJ
C.浓硫酸与稀NaOH溶液反应的中和热△H= 一57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol H2O放出57.3 kJ热量
难度: 中等查看答案及解析
-
已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1:6
C.若有3mol H2O生成,则反应中有2mol电子转移
D.微粒的还原性Cl->Co2+
难度: 中等查看答案及解析
-
某短周期元素Y的最高正价与最低负价的绝对值之差是4;Y元素可与M元素形成离子化合物,并在水中电离出电子层结构相同的阴、阳离子,则该化合物是
A、K2S B、Na2S C、Na2O D、KCl
难度: 中等查看答案及解析
-
用铂作电极电解500 mL含KN03和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为
A.0.5 mol/L B.2 mol/L C.l mol/L D.无法确定
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定不能大量共存的是
A.无色溶液中Na+、Mg2+、NO3-、Cl-
B.使石蕊变红的溶液中Fe3+、NO3-、Na+、SO42-
C.加入Mg能放出H2的溶液中NH4+、Cl-、K+、SO42-
D.由水电离出的c(H+)=10-12mol/L的溶液中Na+、Fe2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.向苯酚钠溶液中通入少量CO2;C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
难度: 中等查看答案及解析
-
室温下,下列叙述正确的是(溶液体积变化忽略不计)
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
pH
11
11
3
3
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 0.1 mol Fe与足量的氯气反应时失去的电子数为0.2 NA
B.标准状况下22.4L SO3含有的分子数为NA
C.6gSiO2晶体中含有的硅氧键数目为0.4NA
D.用Pt做电极电解硫酸铜溶液,当阳极产生的气体在标准状况下为22.4L时,转移电子数目为2NA
难度: 中等查看答案及解析
-
美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲的风潮。奥司他韦的结构如图;下列说法正确的是
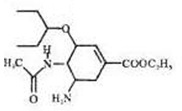
A.奥司他韦是一种芳香族化合物,分子式为C18H28O4N3
B.1mol该化合物可以和3mol氢气发生加成反应
C.该化合物能发生水解反应,加成反应、氧化反应和消去反应
D.奥司他韦可以和磷酸在一定条件下制取奥司他韦磷酸盐是由于具有碱性基团氨基
难度: 中等查看答案及解析
-
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:A(g)+3B(g)
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
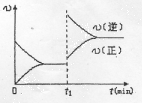
下列说法正确的是
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
编号
实验内容
实验目的
A
将SO2通入溴水,溴水褪色后加热观察能否恢复原色
验证SO2漂白的可逆性
B
将氯水加入淀粉KI溶液中
验证C1的非金属性比I强
C
把铁块和铜块用导线连接插入浓硝酸中
组成原电池验证Fe比Cu活泼
D
加热氯化铵和碘单质的固体混合物
分离除去碘单质
难度: 中等查看答案及解析
-
某1.2 mol ·L-1 Fe2 (SO4) 3和2.4 mol·L-1 CuSO4的混合溶液100 mL,最多能溶解铁粉的物质的量为
A. 0.30 mol B. 0.36 mol C. 0.48 mol D. 0.56 mol
难度: 中等查看答案及解析
-
某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
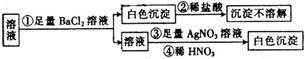
A. 原溶液中一定只含有SO
B. 原溶液中一定含有SO
和Cl—
C. 原溶液中一定只含有Cl—
D. 原溶液中可能含有SO
,也可能含有Cl—
难度: 中等查看答案及解析