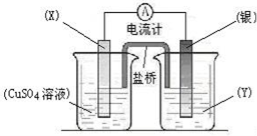
-
下列有关物质的性质与用途具有对应关系的是 ( )
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
下列离子中半径最大的是
A. Na+ B. Mg2+ C. O2- D. F-
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。己知Y、W的原子序数之和是Z的3倍,下列说法正确的是
Y
Z
X
W
A. 原子半径:X<Y<Z B. 气态氢化物的稳定性:X>Z
C. Z、W均可与Mg形成离子化合物 D. 最高价氧化物对应水化物的酸性:X>W
难度: 困难查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
①③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+
难度: 中等查看答案及解析
-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氯气作水的杀菌消毒剂 B. 硅胶作袋装食品的干燥剂
C. 烧结粘土制陶瓷 D. 用含铁粉的透气小袋与食品一起密封包装是为了防止食品受潮
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
Lv的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
难度: 简单查看答案及解析
-
下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物 B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、蔗糖均为电解质 D. 盐水、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
有关原电池的下列说法中正确的是
A. 在外电路中电子由正极流向负极 B. 在原电池中负极发生还原反应
C. 原电池工作时,阳离子向正极方向移动 D. 原电池中正极一定是不活泼金属
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 2.4 g Mg在足量O2中燃烧,转移的电子数为0.1NA
B. 钠在氧气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子为1NA
C. 1 mol Fe溶子过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 LCCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
水溶被中能大量共荐的一组离子是
A. Na+、Ca2+、Cl-、SO42- B. Fe2+、H+、SO32-、ClO-
C. K+、Fe3+、NO3-、SCN- D. Mg2+、NH4+、Cl-、SO42-
难度: 中等查看答案及解析
-
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0 B.△H2>0,△H4>0
C.△H1=△H2+△H3 D.△H3=△H4+△H5
难度: 中等查看答案及解析
-
下列6个装置中,属于原电池的装置有(F中,盐桥能使离子透过一一起导电的作用)
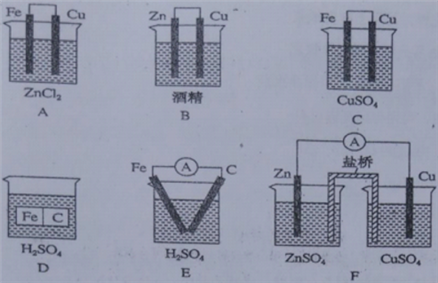
A. 2个 B. 3个 C. 4个 D. 5个
难度: 困难查看答案及解析