-
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池
汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
难度: 简单查看答案及解析
-
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )

A.该反应为放热反应
B.反应物的总能量高于生成物的总能量
C.该反应为吸热反应
D.该反应只有在加热条件下才能进行
难度: 简单查看答案及解析
-
已知2H2(g)+O2(g)=2H2O(g)ΔH1;2H2(g)+O2(g)=2H2O(l)ΔH2。则下列关于ΔH1与ΔH2大小比较中正确的是( )
A.无法确定 B.ΔH1 <ΔH2 C.ΔH1 =ΔH2 D.ΔH1>ΔH2
难度: 中等查看答案及解析
-
已知反应:
①2C(s)+O2(g)=2CO(g)ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol
下列结论正确的是( )
A.碳的燃烧热为110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀醋酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol
D.稀盐酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol
难度: 中等查看答案及解析
-
已知101 k Pa时辛烷的燃烧热为-5518 kJ· mol-1。则下列热化学方程式书写正确的是( )
A.2C8H18+25O2=16CO2+18H2O△H=-11036kJ·mol-1
B.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036kJ·mol-1
C.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(g)△H=-11036kJ·mol-1
D.2C8H18(l)+25O2(g)=16CO2(g))+18H2O(l)△H=-5518kJ·mol-1
难度: 中等查看答案及解析
-
甲、乙两容器中都在进行A
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是( )
A.甲快 B.乙快 C.无法确定 D.相等
难度: 中等查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 中等查看答案及解析
-
对已达化学平衡的下列反应:2X(g)+Y(g)
2Z(g),减小压强时,对反应产生的影响是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,3min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速度增大到原来的3倍,那么40℃时,同样的反应要同样看到浑浊,需要的时间是( )
A.40s B.15s C.30s D.20s
难度: 中等查看答案及解析
-
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是( )
A.C的体积分数降低 B.x+y<z
C.平衡向正反应方向移动 D.B的转化率提高
难度: 中等查看答案及解析
-
在密闭容器中进行反应N2+O2
2NO,下列条件能加快反应速率的是( )
A.增大体积使压强减小 B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大 D.压强不变,充入气体Ne
难度: 中等查看答案及解析
-
可逆反应∶2NO2
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
对于N2(g)+3H2(g)
2NH3(g),不能作为反应达到平衡状态的判断依据是( )
A.恒容密闭容器中总压强不变
B.恒容密闭容器中混合气体的密度不变
C.生成氨气的速率与氨气分解的速率相等
D.N2、H2、NH3的浓度不再发生变化
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g
)2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
难度: 中等查看答案及解析
-
在一密闭容器中进行以下可逆反应:M(g)+N(g)
P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )

A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
难度: 困难查看答案及解析
-
已知H—H键的键能为436 kJ/mol,O=O键的键能为498 kJ/mol,根据热化学方程式H2(g)+
O2(g) =H2O( l ) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
A.485.5 kJ/mol B.610 kJ/mol C.917 kJ/mol D.1220 kJ/mol
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(气)
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60 %,则正确的是( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
难度: 中等查看答案及解析
-
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
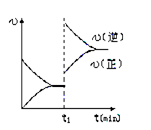
A.2SO2(g)+O2(g)
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g)
2HI(g) ΔH>0
D.N2(g)+3H2(g)
2NH3(g) ΔH<0
难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H=-1025kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )

难度: 中等查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是( )

A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E 1 +E 2
难度: 中等查看答案及解析