-
下列生产工艺不能体现“绿色化学”思想的是( )
A.海水提镁:用电解氯化镁产生的氯气制取盐酸
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:使用稀硫酸、双氧水溶解铜
D.火力发电:在燃煤中加入适量生石灰难度: 中等查看答案及解析
-
下列有关物质“量”的说法正确的是( )
A.相同质量的Al和Al2O3分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,Al2O3消耗碱量多
B.反应N2O4+N2H4→N2+H2O中,若有1 mol N2O4参加反应,则有4 mol电子发生转移
C.由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3
D.1 mol Cl2参加的任何反应,反应过程中转移电子数都是2 NA难度: 中等查看答案及解析
-
下列说法正确的是( )
A.医疗上使用的131I和127I互为同位素
B.C、N、O的最高正价依次升高,对应气态氢化物稳定性依次增强
C.aA+、bB2+、cC--三种离子具有相同的电子层结构,则原子序数c>a>b
D.P、S、Cl原子半径依次减小,对应含氧酸的酸性依次增强难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用点燃的方法鉴别甲烷和乙烯
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
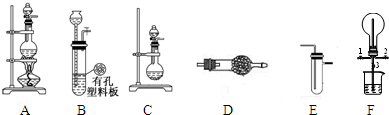
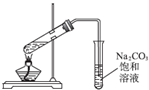
C.实验室常用如图所示的装置制取少量的乙酸乙酯
D.糖类、蛋白质、油脂属于天然高分子化合物难度: 中等查看答案及解析
-
模拟铁的电化学防护的实验装置如图所示,下列说法错误的是( )
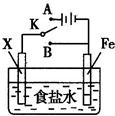
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A处或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,铁电极上发生的反应为2H++2e-═H2↑
D.若X为碳棒,开关K置于A处时,铁电极上发生的反应为2H++2e-═H2↑难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A.常温下,由NH4Cl和NH3•H2O组成的混合液pH一定大于7
B.18g由14C原子形成的甲烷中所含有的C─H键的个数为4NA
C.向2mol/L的CH3COOH溶液中加入等体积1mol/L的NaOH溶液后的混合液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.某温度时,在恒容的容器中反应2SO2(g)+O2(g)⇌2SO3(g)达到平衡时,向体系中充入SO2气体,平衡向正反应方向移动,SO2的转化率提高难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是( )
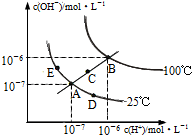
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性难度: 中等查看答案及解析