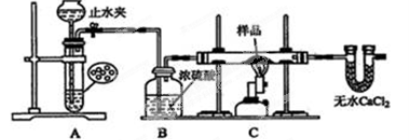
-
2015年6月5日世界“环境日”中国的主题是“践行绿色生活”.下列不符合这一主题的是
A.从自身做起,从身边小事做起,减少超前消费、炫耀性消费、奢侈性消费和铺张浪费现象
B.减少温室气体的排放,倡导“绿色低碳”的生活
C.少开私家车,提倡“绿色出行”
D.向空气中喷洒烧碱溶液,避免酸雨的发生
难度: 简单查看答案及解析
-
下列有关电解质的叙述中错误的是
A.强电解质在水溶液里或熔融状态时的电离方式是一样的
B.弱电解质溶液可能比强电解质溶液的导电性强
C.HCl是强电解质,它只能在水溶液里才能电离
D.电解质溶液导电过程中必然伴随化学变化
难度: 简单查看答案及解析
-
下列物质分类的正确组合是
选项
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
氨水
醋酸
石灰石
水
D
苛性钾
碳酸
胆矾
三氧化硫
难度: 简单查看答案及解析
-
下列离子方程式中,只能表示一个化学反应的是
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH―+2H++SO42―=BaSO4↓+2H2O
③Cl2+H2O=H++Cl―+HClO
④CO32―+2H+=CO2↑+H2O
⑤Ag++Cl―=AgCl↓
A.只有③ B.②③ C.③⑤ D.①④
难度: 简单查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水发生如下反应:
NaBH4+H2O = H2↑+NaBO2(未配平,其中NaBH4中氢元素为﹣1价),则下列说法正确的是
A.被氧化元素与被还原元素的质量比为1:1
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.NaBH4既是氧化剂,又是还原剂
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至Al3+恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.向NH4HSO4溶液中滴加过量NaOH溶液并加热:NH4++OH-
H2O+NH3↑
C.向AlCl3溶液中滴加过量氨水:Al3++4NH3∙H2O=[Al(OH)4]-+4NH4+
D.FeO溶于稀硝酸中:FeO+2H+=Fe2++H2O
难度: 困难查看答案及解析
-
下列说法正确的是
A.摩尔是用来衡量微观粒子多少的一种物理量
B.在一定的温度和压强下,各种气体的摩尔体积相等
C.阿伏加德罗常数的数值是0.012 kg 14C所含的原子个数
D.若气体摩尔体积为22.4 L•mol﹣1,则所处条件为标准状况
难度: 简单查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O2、MgO、Al2O3均属于碱性氧化物
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
难度: 简单查看答案及解析
-
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
编号
化学反应
离子方程式
评 价
A
碳酸钙与醋酸反应
CO32-+2CH3COOH =CO2↑+H2O+2CH3COO-
错误,碳酸钙是弱电解质,不应写成离子形式
B
NaAlO2溶液中通入过量CO2
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
正确
C
NaHCO3的水解
HCO3-+H2O
CO32-+H3O+
错误,水解方程式误写成电离方程式
D
等物质的量的FeBr2和Cl2反应
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl -
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符
难度: 困难查看答案及解析
-
某溶液中含有NH4+、SO32-、SiO32-、Br- CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有四种
②有胶状物质生成
③有刺激性气味气体产生
④溶液颜色发生变化
⑤溶液中至少发生了3个氧化还原反应
A.①②③④ B.①②③④⑤
C.①③④⑤ D.②④⑤
难度: 中等查看答案及解析
-
a、b、c、d是HCl、AlCl3、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表.由此推出a、b、c、d依次为
反应物
a+b
c+d
a+d
a+c
b+d
现象
↓
↓↑
↓
↓
↑
A. AlCl3、HCl、AgNO3、Na2CO3 B. AgNO3、HCl、Na2CO3、AlCl3
C. Na2CO3、AlCl3、HCl、AgNO3 D. AgNO3、HCl、AlCl3、Na2CO3
难度: 中等查看答案及解析
-
FeCl3、CuCl2混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色
B.溶液中一定含有Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含铜
难度: 中等查看答案及解析
-
火法炼铜的原理为Cu2S+O2
2Cu+SO2,下列说法中正确的是
A.Cu2S只作还原剂
B.S元素发生还原反应
C.该反应既是氧化还原反应又是置换反应
D.当1 mol O2参加反应时,共转移4 mol e-
难度: 简单查看答案及解析
-
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到的仪器组合正确的是
①100 mL量筒;②10 mL量筒;③50 mL 烧杯;④托盘天平;⑤100 mL容量瓶;⑥胶头滴管;⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥
C.③⑤⑦⑥① D.④③⑦⑤⑥
难度: 中等查看答案及解析
-
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是
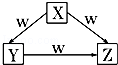
X
Y
Z
W
A
C
CO
CO2
O2
B
Na
Na2O
Na2O2
O2
C
AlCl3
Al(OH)3
NaAlO2
NaOH
D
Fe
FeCl2
FeCl3
Cl2
难度: 中等查看答案及解析
-
下列实验操作中,装置选择不合理的是
A
B
C
D
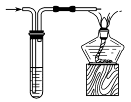

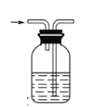
洗气瓶
快速制备少量NH3
H2的尾气处理
测量NO的体积
除去乙烯中的SO2
难度: 中等查看答案及解析