-
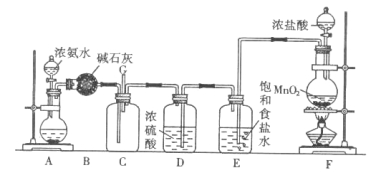
某化学兴趣小组利用MnO2和浓HCl及如图装置制备Cl2。下列分析中不正确的是

A.A中可用分液漏斗代替长颈漏斗
B.A中缺少加热装置
C.B中盛放的NaOH溶液可以净化Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是
A.Cl2中混有少量HCl:通过盛有硝酸银溶液的洗气瓶
B.Cl2中混有少量水蒸气:通过足量浓硫酸,收集气体
C.Cl2中混有少量HCl:通过碱石灰后收集气体
D.HCl中混有少量Cl2:通入氢气光照
难度: 中等查看答案及解析
-
下列溶液中:①石灰水 ②Na2S溶液 ③KMnO4溶液 ④溴水
⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.②④⑤ B.①② C.①②⑤ D.只有①
难度: 简单查看答案及解析
-
下列各分子中所有原子都满足最外层为8电子结构的是
A.BeCl2 B.PCl3 C.PCl5 D.H2S
难度: 中等查看答案及解析
-
下列物质中,既含有极性键又含有非极性键的是:
A.CH2=CH2 B.CO2 C.Na2O2 D.NH4Cl
难度: 简单查看答案及解析
-
下列物质的转化在指定条件下能实现的是

A.①④⑤ B.①②④ C.②③⑤ D.①②⑤
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是

A.工业上通过电解熔融状态MgCl2制取金属镁
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第②、④步骤中,溴元素均被氧化
D.制取NaHCO3的反应是利用其溶解度小于NaCl
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D.若甲为NaHCO3,则丁可能是HCl
难度: 中等查看答案及解析
-
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.温度不变同时充入Ar
D.降低温度同时增大压强
难度: 中等查看答案及解析
-
下列有关实验现象和解释或结论都正确的是
选项
实验操作
实验现象
解释或结论
A
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应2NO2
N2O4的
△H<0
B
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡
下层分别呈无色 和紫红色
还原性:I- >Br- >Fe2+
C
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水
有白色沉淀出现
该钾盐是K2CO3
D
把SO2通入紫色石蕊试液中
紫色褪去
SO2具有漂白性
难度: 中等查看答案及解析
-
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是:①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应
A.②③⑤ B.②③④⑥
C.①④⑤ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、高压、使用催化剂
难度: 中等查看答案及解析
-
某同学对一瓶Na2SO3固体样品进行如下实验:取出少量,加水完全溶解,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,仍有白色沉淀剩余。下述叙述正确的是
A.无法确定样品中钠、硫元素的质量比
B.Na2SO3已被氧化
C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
D.加入稀硝酸后的沉淀一定是BaSO4
难度: 中等查看答案及解析
-
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
A.元素Y、P的简单氢化物中化学键类型相同
B.原子半径:X>Y
C.最高价氧化物的水化物酸性:P<Q
D.X、Q两元素的最高正化合价相同
难度: 中等查看答案及解析
-
下列物质间的转化在给定条件下能一步实现的是
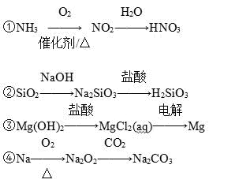
A.①②③ B.③④ C.①④ D.②④
难度: 中等查看答案及解析
-
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化
C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D.漂白粉和水玻璃长期暴露在空气中变质
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是

A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.e内气体颜色变浅,d内气体颜色加深
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
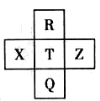
A.非金属性:Z<T<X
B.最高价氧化物的水化物的酸性:Q>T
C.气态氢化物稳定性:R<T<Q
D.R与Q的电子数相差26
难度: 中等查看答案及解析
-
下列对实验现象的预测不正确的是
A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失
B.向Na2CO3饱和溶液中通入CO2,溶液变浑浊,继续通入CO2,有晶体析出
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
难度: 中等查看答案及解析
-
有关化学键和化合物的叙述不正确的是
A.盐酸中含有H+和Cl-,所以HCl是离子化合物
B.Na2O2中含有离子键和非极性共价键
C.完全由非金属元素组成的化合物可能是离子化合物
D.双原子或多原子的单质分子中均存在化学键
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Zn(s)+
O2(g)===ZnO(s) ΔH1=-351.1 kJ/mol
Hg(l)+
O2(g)===HgO(s) ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg( l) ΔH3,其中ΔH3是
A.-441.8 kJ/mol B.-254.6 kJ/mol
C.-260.4 kJ/mol D.-438.9 kJ/mol
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g),△H=-890.3 kJ·mol-1
B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g),△H = -38.6 kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H = -57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H = 2×(-57.3)kJ·mol -1
D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1),△H = -571.6 kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)
xC(g) △H<0,B、C的物质的量随时间变化的关系如图l,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
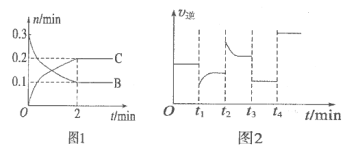
A.x=2,反应开始2 min内VB=0.1mol·L-1·min-1
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数减小
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
难度: 中等查看答案及解析