-
由CO2和H2组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中,CO2和H2的物质的量之比为
A.8∶13 B.1∶1 C.13∶8 D.1∶2
难度: 简单查看答案及解析
-
下列各步反应A(HCl)→B(Cl2)→C〔Ca(ClO)2〕→D(HClO)→E(CO2),其中不能直接实现的是
A. A→B B. B→C C. C→D D. D→E
难度: 中等查看答案及解析
-
下列物质中,同时含有氯分子,氯离子的是
A、氯酸钾溶液 B、液态氯化氢 C、液氯 D、氯水
难度: 简单查看答案及解析
-
钠与水反应的现象和钠的下列性质无关的是
A. 钠的熔点较低 B. 钠的密度小于水 C. 钠的硬度较小 D. 钠的还原性强
难度: 中等查看答案及解析
-
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为( )
A. 5.8 g·mol-1 B. 11.6 g·mol-1
C. 23.2 g·mol-1 D. 46.4 g·mol-1
难度: 中等查看答案及解析
-
ClO2是一种高效安全的绿色杀菌剂,下列有关ClO2制备与杀菌的说法不合理的是
A. 可用Cl2和NaClO2制备ClO2, 其中n (氧化剂) : n (还原剂) = 1:2
B. ClO2在强碱性环境中使用失效:2ClO2+2OH-=ClO3-+ClO2-+H2O
C. ClO2处理饮用水时残留的ClO2-,可用FeSO4来除去:ClO2-+2Fe2++4H+=2Fe3++Cl-+2H2O
D. 等物质的量的ClO2杀菌效果比Cl2、HClO强
难度: 困难查看答案及解析
-
某溶液中可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+与OH-),取200mL该溶液,分成两等份进行以下实验。
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g,下列说法正确的是( )
A. 该溶液中可能含有K+ B. 该溶液中肯定含有NO3-、SO42-、NH4+、CO32-
C. 该溶液中一定不含有NO3- D. 该溶液中一定含K+,且c(K+)≥0.1mol/L
难度: 困难查看答案及解析
-
现有CuO、FeO、Fe2O3组成的混合物mg,向其中加入100mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为
A. (m-3.2)g B. (m-1.2)g C. (m-1.6)g D. 无法计算
难度: 困难查看答案及解析
-
向100mLNaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得固体灼烧至恒重,得到mg固体。m与通入Cl2的体积[V(Cl2),标准状况]关系如图所示。则下列说法不正确的是
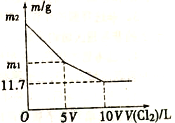
A. V=0.224 B. 混合溶液中:c(Na+)=2 mol/L
C. m2=25.3 D. m1=18.55
难度: 中等查看答案及解析
-
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是( )
A. 该反应中氧化剂是Cl2
B. 根据该反应可判断还原性:S2O32->Cl-
C. 上述反应中,每生成l mol SO42-,可脱去2mol Cl2
D. SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂
难度: 简单查看答案及解析




