-
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1,则H2的燃烧热为241.8 kJ•mol﹣1
B.若C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2
难度: 中等查看答案及解析
-
下列做法与社会可持续发展理念相违背的是
A.将作物秸秆通过化学反应转化为乙醇用作汽车燃料
B.使用资源节约型、环境友好型的生物降解塑料包装袋
C.大力研发新型有机溶剂替代水作为萃取剂
D.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
难度: 简单查看答案及解析
-
下列有关化学用语的表达正确的是
A.甲醛的电子式:
B.TNT 结构简式:
C.乙醛的结构简式为:CH3CHO
D.1,3﹣二甲基丁烷:
难度: 中等查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe﹣3e﹣═Fe3+
难度: 中等查看答案及解析
-
如图是某同学设计的原电池装置,下列叙述中不正确的是
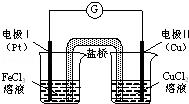
A.电极Ⅰ上发生还原反应,作原电池的正极
B.电极Ⅱ的电极反应式为:Cu﹣2e﹣═Cu2+
C.该原电池的总反应为:2Fe3++Cu═Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
下列关于各实验装置图的叙述中正确的是
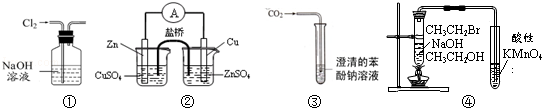
A.装置①:除去Cl2中含有的少量HCl
B.装置②:构成锌﹣铜原电池
C.装置③:可用于比较碳酸与苯酚的酸性强弱
D.装置④:验证溴乙烷发生消去反应生成烯烃
难度: 中等查看答案及解析
-
可逆反应N2(g)+3H2(g)⇌2NH3(g),500℃时在容积为10L的密闭容器中进行,开始时加入1mol N2和6mol H2,则达到平衡时,NH3的浓度不可能达到
A.0.1 mol•L﹣1 B.0.2 mol•L﹣1 C.0.05 mol•L﹣1 D.0.15 mol•L﹣1
难度: 中等查看答案及解析
-
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列关于说法正确的是
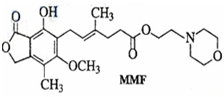
A.MMF能溶于水
B.MMF能发生取代反应和消去反应
C.1mol MMF能与6mol氢气发生加成反应
D.1mol MMF能与含3mol NaOH的水溶液完全反应
难度: 困难查看答案及解析
-
臭氧是理想的烟气脱硝试剂,其脱销反应为:2NO2(g)+O3(g)⇌N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是
A
B
C
D
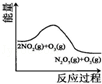



升高温度,平衡常数减小
0﹣3s内,反应速率为:v(NO2)=0.2 mol•L﹣1
t1时仅加入催化剂,平衡正向移动
达平衡时,仅改变x,则x为c(O2)
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1
(2)C(s)+O2(g)=CO2(g)△H2
(3)2H2(g)+O2(g)=2H2O(l)△H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l)△H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H5
下列关于上述反应的焓变的判断正确的是
A.△H1>0,△H2<0 B.△H5=2△H2+△H3﹣△H1
C.△H3>0,△H5<0 D.△H4=△H1﹣2△H3
难度: 困难查看答案及解析
-
某兴趣小组设计如下微型实验装置.实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl﹣
Cl2↑+H2↑
B.断开K2,闭合K1时,铜电极附近溶液先变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e﹣═2Cl﹣
D.断开K1,闭合K2时,石墨电极作正极
难度: 困难查看答案及解析
-
可逆反应mA(s)+nB(g)⇌eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是
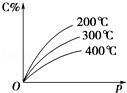
A.达到平衡后,若升高温度,平衡右移
B.达到平衡后,加入催化剂C%增大
C.化学方程式中“n>e+f”
D.达到平衡后,增加A的量有利于平衡向右移动
难度: 困难查看答案及解析
-
用惰性电极电解下列溶液一段时间后,再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是
A.AgNO3[AgNO3] B.NaOH[H2O] C.KCl[KCl] D.CuSO4[Cu(OH)2]
难度: 中等查看答案及解析
-
香豆素类化合物具有抗病毒、抗癌等多种生物活性,香豆素﹣3﹣羧酸可由水杨醛制备.下列说法正确的是

A.水杨醛分子中所有原子可能处于同一平面上
B.中间体X易溶于水
C.香豆素﹣3﹣羧酸能使酸性高锰酸钾溶液褪色
D.lmol水杨醛最多能与3 molH2发生加成反应
难度: 困难查看答案及解析
-
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是
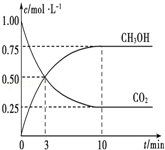
A.欲增大平衡状态时
的比值,可采用升高温度的方法
B.达到平衡状态时,CO2的平衡转化率为75%
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L﹣1•min﹣1
难度: 困难查看答案及解析


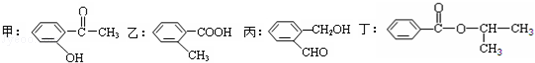
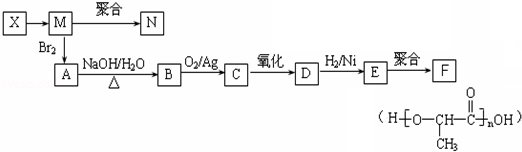
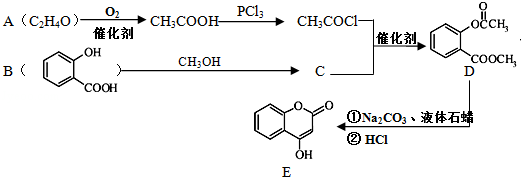
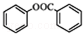 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)