-
下列物质的使用不涉及化学变化的是( )
A. 明矾用作净水剂 B. 氢氟酸刻蚀玻璃
C. 生石灰作干燥剂 D. 液氨用作致冷剂
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na + O2 = Na2O2
B. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++ SO42 - = BaSO4↓
C. 铅酸蓄电池充电时的正极反应:PbSO4 + 2H2O-2e- = PbO2+4H++SO42 -
D. 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3- + Ca2++ 2OH- = CaCO3↓+ CO32-+ 2H2O
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. 原子半径Z<M
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是 ( )
A.
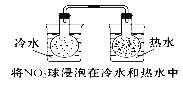
B.

C.

D.
难度: 中等查看答案及解析
-
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为 ( )
A. +350 B. +130 C. -332 D. -118
难度: 中等查看答案及解析
-
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为
混合溶液。下列叙述错误的是 ( )
A. 待加工铝质工件为阳极 B. 硫酸根离子在电解过程中向阳极移动
C. 可选用不锈钢网作为阴极 D. 阴极的电极反应式为:
难度: 中等查看答案及解析
-
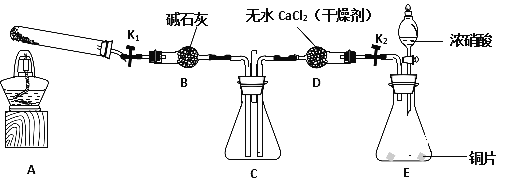
下列有关实验的说法中正确的是

A. 用图1装置制取干燥纯净的NH3
B. 实验室可以用图2装置制备Fe(OH)2
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生的NO2体积
难度: 中等查看答案及解析


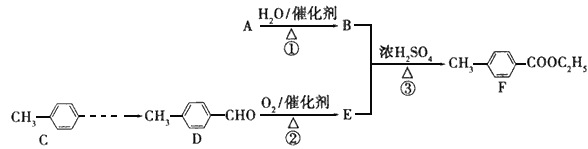
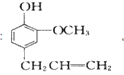 。丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下:
。丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下: