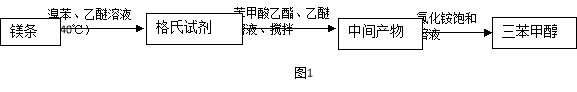
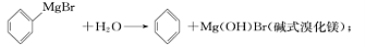
-
“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是( )
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
难度: 简单查看答案及解析
-
下列物质分类正确的是( )
A、SO2、SiO2、 CO均为酸性氧化物
B、稀豆浆、硅酸、氯化铁溶液均为胶体
C、烧碱、冰醋酸、四氯化碳均为电解质
D、福尔马林、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A、硫酸铝溶液与过量Ba(OH)2溶液反应
2Al3+ + 3SO42- +3 Ba2++8OH-=3BaSO4↓+2A1O2- +4H2O
B、碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:
CO32-+2H+=CO2↑+H2O
C、酸性高锰酸钾溶液与H2O2溶液混合:
2MnO4-+3H2O2+6H+=2Mn2++6H2O+402↑
D、氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO
难度: 中等查看答案及解析
-
在标准状况下, m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m∶n
B.同质量的气体A与B的分子个数比为n∶m
C.同温同压下,A气体与B气体的密度比为n∶m
D.同温同压下,同体积的A气体与B气体的质量比为m∶n
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项
目的
分离方法
原理
A.
分离氢氧化铁胶体和氯离子
盐析
胶体不能透过半透膜,离子能
B.
分离植物油和水的混合物
分液
二者互不相溶且沸点不同
C.
除去苏打中少量小苏打
加热
二者的溶解度不同
D.
除去乙醇中的乙酸
蒸馏
乙醇与乙酸沸点相差较大
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 LSO3含有NA个分子
B.6.4g氧气和3.2g臭氧(O3)混合气体所含有的氧原子数为0.6NA
C.过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2NA
D.标准状况下,2.24L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1NA
难度: 中等查看答案及解析
-
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2说法正确的是( )
SO2属于非法添加剂,不该添加到葡萄酒中
SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
SO2具有还原性,不能用浓硫酸干燥
SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是: ( )
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.1mol Na2O2 固体中含离子总数为4 NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.I的原子半径大于Br,HI比HBr的热稳定性强
B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C.Al2O3和MgO均可与NaOH溶液反应
D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
难度: 中等查看答案及解析
-
下列离子在指定条件下能大量共存的是 ( )
A.能使石蕊试液显红色的溶液中:NH4+、Fe 2+、Al3+、NO3-
B.加入NH4HCO3能产生气体的溶液中:K+、Na+、I-、SO42-
C.中性透明溶液中:K+、HCO3-、NO3-、Fe3+
D.常温下由水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32-
难度: 困难查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的
是( )
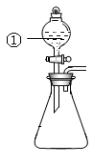
选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C.
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D.
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11) ( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2O
HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO-
难度: 中等查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是 ( )
A.参加反应的硝酸是0.4mol B.混合气体中含NO21.12 L
C.此反应过程中转移的电子为0.3 mol D.消耗氧气的体积为1.68 L
难度: 中等查看答案及解析
-
下列实验的现象、解释或结论正确的是( )
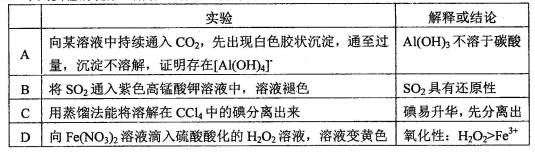
难度: 中等查看答案及解析
-
向100mLpH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后, 生成NO气体448mL(标准状况)。则反应前的混合溶液中含硫酸的物质的量浓度为( )
A.0.8mol·L-1 B.0.4mol·L-1 C.0.08mol·L-1 D.0.04mol·L-1
难度: 中等查看答案及解析