-
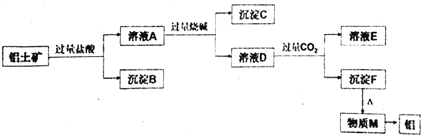
向下列六种饱和溶液中分别持续通入CO2气体,最终得到沉淀或析出晶体的一组是( )
① Ba(NO3)2 ② Ca(OH)2 ③Na2SiO3④NaA1O2⑤ Na2CO3⑥ NH3和NaCl
A. ①③④⑥ B. ②③④⑥ C. ③④⑤⑥ D. ①②③⑤
难度: 中等查看答案及解析
-
物质在化学反应前后,可能发生变化的是
A. 原子总数 B. 质子总数 C. 电子总数 D. 分子总数
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. l L1 mol/L的盐酸溶液中,所含氯化氢分子数为NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
难度: 中等查看答案及解析
-
离子甲与微粒乙在溶液中的转化关系如下图所示,则离子甲不可能是

A. HCO3- B. NH4+ C. A13+ D. Mg2+
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O
B. 向NH4HSO3溶液中滴加足量KOH溶液:NH4++OH-=NH3•h2o
C. 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,能使淀粉溶液变蓝:2I-+H2O2+2H+=I2+2H2O
D. 盐碱地(含较多NaCl、Na2CO3)中加入石膏,降低土壤的碱性,涉及的方程式为:Ca2++CO32-=CaCO3↓
难度: 困难查看答案及解析
-
下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是( )
选项
离子组
试剂
离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B
Fe3+、I-、ClO-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
C
Ba2+、HCO3-、Cl-
NaOH溶液
HCO3-+ OH-=CO32-+H2O
D
Ag+、NO3-、Br-
过量浓氨水
Ag++OH-=AgOH↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是
A. 转移电子4.8NA个 B. 生成气体的体积42.56 L(标准状况)
C. 还原剂比氧化剂多0.2 mol D. 被还原的氮原子是ll.2 g
难度: 困难查看答案及解析
-
有3份等质量的小苏打,第1份直接与盐酸恰好完全反应:第2份首先加热, 使其部分分解后,再与足量盐酸恰好完全反应:第3份首先加热,使其完全分解后,再与足量盐酸恰好完全反应。假若盐酸的物质的量浓度相同,消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. KIO3+6HI==KI+3H2O+3I2,生成3 mol I2转移电子的总数为5NA
B. 标准状况下,5.6L氧气中含有O的总数为0.5NA
C. 20g氖气中所含的原子数目为NA
D. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为2NA
难度: 中等查看答案及解析
-
向含有0.2 mol FeI2溶液中加入a mol Br2。下列叙述不正确的是( )
A. a=0.1 时,发生的反应为 2I-+Br2=I2+2Br-
B. a=0.25 时,发生的反应为 4Fe2++6I-+5Br2=4Fe3++3I2+10Br-
C. 溶液中的I-一半被氧化时,c(I-)∶c(Br-)=l∶l
D. 0.2<a<0.3时(不考虑碘与水反应),溶液中各离子浓度的关系为:2c(Fe2+)+ 3c(Fe3+)+c(H+)=c(Br-)+c(OH-)
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 34 g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
B. 反应 3H2(g)+N2(g)
2NH3(g)△H=-92 kJ·mol-1 ,若放出热量4.6kJ,则转移电子数目为0.3NA
C. 常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算
D. 6.4 g Cu与40 mL l0mol·L-1 浓硝酸作用能生成NO2的分子数为0.2NA
难度: 困难查看答案及解析
-
中学化学中很多“规律”都有其使用范围,据有关“规律”下列结论合理的是
A. 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HC1O
B. 金属钠可以通过电解熔融NaCl制得,推出金属铝可以通过电解熔融A1Cl3制得
C. 金属钠在纯氧中燃烧生成Na2O2,推出金属锂在纯氧中燃烧生成Li2O2
D. CaCO3与稀硝酸反应生成CO2,推出CaSO3也能与稀硝酸反应生成SO2
难度: 中等查看答案及解析
-
某学生鉴定某可溶性甲盐的流程如图所示,下列说法正确的是
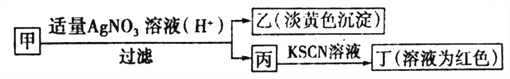
A. 如果甲中含有S2-,则乙是硫黄沉淀
B. 如果乙是AgCl沉淀,那么甲是FeCl3
C. 丙中肯定含有Fe3+,所以甲是FeBr2
D. 甲中含有铁元素,可能显+2或者+3价
难度: 困难查看答案及解析
-
根据SO2通入不同溶液中实验现象,所得结论不正确的是
溶液
现象
结论
A
含 HC1、BaCl2的 FeCl3溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 活性炭具有还原性,可用作冰箱除味剂
B. 二氧化硫具有氧化性,可用作造纸漂白剂
C. Al2O3具有很髙的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
难度: 中等查看答案及解析
-
下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小②二氧化硫和氯气均能使品红溶液褪色③二氧化硫能使品红溶液、溴水褪色④氨气和碘化氢气体均不能用浓硫酸干燥⑤常温下浓硫酸用铁制容器存放、加热条件下浓硫酸能与木炭反应⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
A. ③④ B. ⑤⑦ C. ③④⑥⑦ D. 全部
难度: 中等查看答案及解析