-
2017年国家科技奖刚刚宣布。下列有关内容都涉及这些奖项。下列说法中不正确的是
A. 太阳能光解水制氢气涉及到物理过程和化学过程
B. 碳纤维、石墨烯和富勒烯互为同素异形体
C. 纳米材料、磁性材料、金属材料、捡杂半导体材料能体现新的功能及用途
D. 高能量密度炸药、芳香化合物、卤代经、植物油都是有机物,其中植物油属于天然高分子
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述错误的是
A. 80gCuO和Cu2S的混合物中,所含铜原子数为NA
B. 1molNaBH4与足量水反应(NaBH4+H2O=NaBO2+H2↑)时转移的电子数为:4NA
C. pH=13的Ba(OH)2溶液中,含有OH-0.2NA个
D. 密闭容器中PCl3与Cl2反应生成molPCl5(g),增加2A个P-C1键
难度: 简单查看答案及解析
-
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是
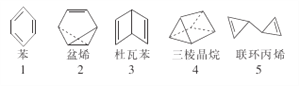
A. 1~5对应的结构中的一氯取代物只有1种的有3个
B. 1~5对应的结构均能使溴的四氯化碳溶液褪色
C. 1~5对应的结构中所有原子均可能处于同一平面的有1个
D. 1~5对应的结构均不能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
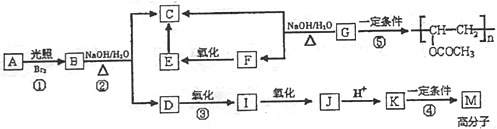
短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
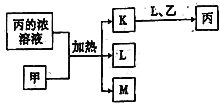
A. 元素的非金属性:Z>Y>X
B. 丙也可由W、Y组成的某种化合物与K直接反应制得
C. 原子半径: W<X<Y
D. K、L、M中沸点最高的是M
难度: 简单查看答案及解析
-
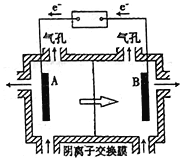
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚
,同时利用此装置的电能在铁上镀铜,下列说法正确的是
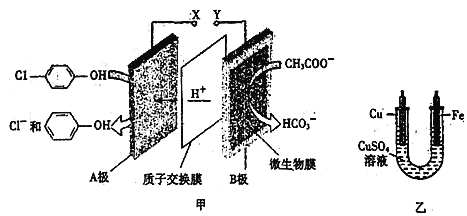
A. 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.2NA
B. A极的电极反应式为
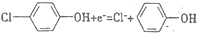
C. 铁电极应与Y相连接
D. 反应过程中甲中右边区域溶液pH逐渐升高
难度: 中等查看答案及解析
-
用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置
①
②
实验现象
结论
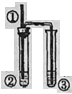
A
铜丝
稀硝酸
②出现红棕色气体
硝酸与铜生成了NO2③中需要碱溶液吸收尾气
B
底端灼热的碳棒
浓硝酸
②中出现红棕色气体
产生气体一定是混合气体
C
铜丝
Fe2(SO4)3溶液
②中溶液黄色变浅
Cu与Fe2(SO4)3溶液发生置换反应
D
铁丝
浓硫酸
无明显现象
铁与浓硫酸不反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
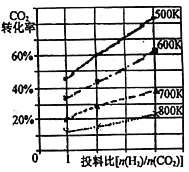
常温下,将11.65gBaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是

A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3
D. 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(Ba2+)
难度: 困难查看答案及解析