-
化学与生活、生产密切相关,下列说法正确的是
A.碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用
B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外
C.工业生产玻璃和水泥,均需要用纯碱为原料
D.“地沟油”的主要成分是油脂,其组成与汽油、煤油不相同
难度: 中等查看答案及解析
-
下列说法正确的是
①经分析某物质只含有一种元素,则该物质一定是单质;
②根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
③NO2和水反应能生成硝酸,但NO2不是酸性氧化物
④溶液是电中性的,胶体是带电的
⑤不能发生丁达尔效应的分散系有氯化钠溶液、水等
A.①③④ B.仅③ C.仅⑤ D.②③④⑤
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数,下列叙述正确的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.1molFe与过量的稀HNO3反应,转移的电子数为2 NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,l L 0.50 mol/LNH4C1溶液与2 L0.25mol/LNH4C1溶液NH4+的离子数均为0.5NA
难度: 困难查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 中等查看答案及解析
-
下列有关化学概念或原理的论述中,正确的是
A.SO2、NH3的水溶液都能够导电,因此都属于电解质
B.电解饱和食盐水的过程中,水的电离平衡逆向移动
C.任何一个氧化还原反应都可以设计为电池,输出电能
D.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
难度: 简单查看答案及解析
-
下列陈述I、II均正确且有因果关系的是
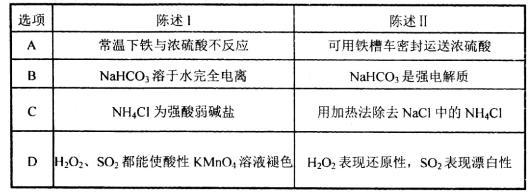
难度: 简单查看答案及解析
-
下列叙述正确的是
A.目前使用的元素周期表中,最长的周期含有36种元素.
B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素
C.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
难度: 简单查看答案及解析
-
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S=6Ag+A12S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgC1
难度: 中等查看答案及解析
-
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g)
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
A.B的平均消耗速率为0.3mol/(L
min)
B. C的平衡浓度为2mol/L
C.平衡后,增大压强,平衡将向正方向移动
D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡
难度: 中等查看答案及解析
-
下列溶液中通入SO2一定不会产生沉淀的是
A.BaCl2 B.Ba
C. Na2S D.Ba(OH)2
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A.由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Na+、Cl-
B.酸性溶液中可能大量存在Na+、ClO
、SO42-、I
C.含有0.1 mol/L Fe3+ 的溶液中可以大量存在:K+、Mg2+、I-、NO3-
D.室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42-
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.硅酸钠溶液与醋酸溶液混合:
+
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:
1
A1
D.向次氯酸钙溶液通入
+
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
①I2(g)+H2(g)
2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g)
2HI(g)△H=+26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
用铝制易拉罐收集满CO2,快速加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响,并变瘪了:过一会儿,易拉罐又会作响并鼓起来。下列说法正确的是
A.导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3-
B.导致易拉罐又鼓起来的反应是:
C.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
D.上述过程中与NaOH溶液反应的物质有三种,且反应结束后的溶液显碱性
难度: 简单查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作
实验目的或结论
A
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
除去MgCl2溶液中少量FeCl3
B
向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失
证明溶液中含有SO42-
C
向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水
,石灰水变浑浊
证明该溶液中存在CO32-
D
向0.1mol•L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色
说明Fe2+具有氧化性
难度: 中等查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:下列判断正确的是
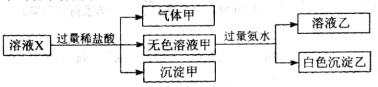
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、Al(OH)4-和SiO32-一定存在于溶液X中
D.CO32-和SO42-一定不存在于溶液X中
难度: 中等查看答案及解析
-
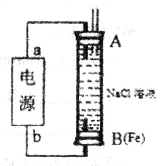
将下图所示实验装置的K闭合,下列判断正确的是

A.Cu电极上发生还原反应
B.电子沿
路径流动
C.片刻后甲池中
增大
D.片刻后可观察到滤纸b点变红色
难度: 中等查看答案及解析
-
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知:
==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
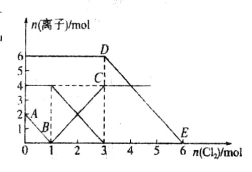
A.还原性:I->Fe2+>Br-
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n (
)=6 mol
难度: 中等查看答案及解析
-
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:

下列说法正确的是
A. Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl
B.相同条件下电离程度比较:HCO3->HSO3->HClO
C.6种溶液中,Na2SiO3溶液中水的电离程度最小
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
难度: 中等查看答案及解析
-
常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
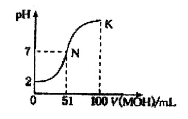
A.HA为一元强酸,MOH为一元强碱
B.K点所示溶液中c(A-)>c(M+)
C.N点水的电离程度小于K点水的电离程度
D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
难度: 困难查看答案及解析
-
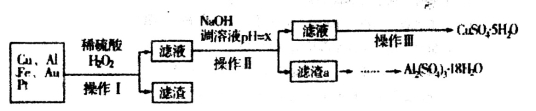
(3分)下列有关实验的叙述中,合理的是__________
A实验室中少量金属钠、钾保存在汽油中
B容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
C圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
D用一定浓度的盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管记录起始体积时,平视读数,终点时俯视,所测碱的浓度偏高
E.不用其它化学试剂即可鉴别
四种无色溶液
F.可以用渗析的方法除去淀粉溶液中的氯化钠
难度: 中等查看答案及解析