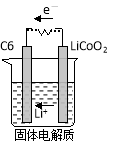
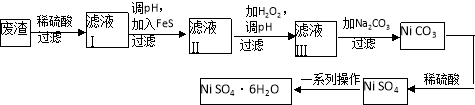
-
下列说法正确的是
A.硅太阳能电池板在工作时,可以将化学能转化为电能
B.淀粉和纤维素均可水解生成葡萄糖,故均可作为人类的营养物质
C.232Th 转换成233U是化学变化,233U和235U的化学性质几乎相同
D.发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品
难度: 中等查看答案及解析
-
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z)
B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应
C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z
D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述正确的是
A.甲烷和氯气的反应与乙酸乙酯水解的反应属于同一类型的反应
B.蛋白质和油脂虽然都属于高分子化合物,但水解生成的产物不同
C.石油化工得到的产品均为液体,煤化工得到的产品有液体,也有固体
D.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量多于乙烯的
难度: 中等查看答案及解析
-
下列有关实验的做法错误的是
A.用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出
B.检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体
C.通过分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
难度: 中等查看答案及解析
-
下列说法正确的是(N A表示阿伏加德常数)
A.1molCu与足量硫反应生成Cu2S,转移的电子数为2 N A
B.R2+的质量数为A,中子数为N,则ngR该价态的氧化物中含质子数为
N A
C.氯化铁生成Fe(OH)3 胶体的离子方程式:Fe3++3H2O =Fe(OH)3↓+3H+
D.在加入铝片能生成氢气的溶液中一定共存的离子组:Na+、Ba2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列图象描述正确的是

A.图①表示体积和PH值均相同的稀硫酸和醋酸,和足量的镁反应生成H2量的关系
B.图②表示向氨水中滴加醋酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g)
2SO3(g)反应中,SO2和O2反应速率大小关系
D.图④表示向H2S中通入Cl2时,溶液的pH大小变化关系
难度: 中等查看答案及解析
-
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的

A.A曲线代表25℃时水的电离平衡曲线
B.当95℃时,pH=6的溶液呈中性
C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸
难度: 中等查看答案及解析