-
下列说法不正确的是( )
A.焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应
B.在同一条件下物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.一个反应能否自发进行取决于反应放热还是吸热
D.一个反应能否自发进行与焓变和熵变的共同影响有关
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是( )
A.H2S
2H++S2- B.H2S + H2O
H3O++HS-
C.NH3+H2O===NH
+OH- D.
HClO===H++ClO-
难度: 简单查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
在0.1mol/L的CH3COOH溶液
中,要促进醋酸电离且氢离子浓度增大,应采取的措施是( )
A.升温 B.降温 C.加入NaOH溶液 D.加入稀HCl
难度: 中等查看答案及解析
-
下列试纸中测溶液的性质时,预先不能用蒸馏水润湿的是( )
A. 红色石蕊试纸 B. 蓝色石蕊试纸 C. KI淀粉试纸 D. pH试纸
难度: 简单查看答案及解析
-
对于纯水在25℃和80℃的pH( )
A.前者小于后者 B.前者等于后者 C.前者大于后者 D.无法确定
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.
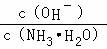
B.

C.c(H+)和c(OH﹣)的乘积 D.OH﹣的物质的量
难度: 中等查看答案及解析
-
25°C时某溶液中由水电离出的c(OH﹣)=1×10﹣13mol/L,该溶液中一定不能大量共存的离子组
是( )
A.NH4+、Fe3+、SO42﹣、Cl﹣ B.CO32﹣、PO43﹣、K+、Na+
C.Na+、SO42﹣、NO3﹣、Cl﹣ D.HPO42﹣、Na+、HSO3﹣、K+
难度: 中等查看答案及解析
-
常温下,在pH都等于9的NaOH和CH
3COONa两种溶液中,设由水电离产生的OH﹣离子浓度分别为amol/L与bmol/L,则A和B关系为( )
A.a>b B.a=10﹣4 b C.b=10﹣4 a
D.a=b
难度: 中等查看答案及解析
-
在25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4)+分别为a、b、c(单位为mol/L).下列判断正确的是( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
难度: 中等查看答案及解析
-
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A.a mL B.(50﹣a)mL C.大于(50﹣a)mL D.大于a mL
难度: 中等查看答案及解析
-
有体积相同、相等pH的烧碱溶液和氨水,下列叙述中正确的是( )
A.两溶液物质的量浓度相同 B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH﹣离子浓度相同 D.加入等体积的水稀释后,pH仍相等
难度: 中等查看答案及解析
-
物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是 ( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
难度: 中等查看答案及解析
-
温度相同,浓度均为0.2mol•L﹣1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤ B.①③⑤④② C.③②①⑤④ D.⑤②④①③
难度: 中等查看答案及解析
-
在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
难度: 中等查看答案及解析
-
将下列物质溶于水,能够促进水的电离的是:①NaHSO4 ②NaHSO3 ③CH3COOH ④CH3COONa ⑤NaHCO3 ⑥NaClO ⑦NH4HCO3( )
A.②④⑤⑥ B.④⑤⑥⑦ C.①②③ D.②④⑤⑥⑦
难度: 中等查看答案及解析
-
在0.1mol/L的硫化钠溶液中,下列关系正确的是的
A.c(Na+)>c(S2-)>c(H+)>c(HS-)>c(OH-)
B.c(OH-)=c(H+)+c(HS-)+c(H2S)
C.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D.c(S2-)+c(HS-)+c(H2S)=0.1mol/L
难度: 中等查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl﹣>c(NH4+)>c(OH﹣)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO﹣)>c(OH﹣)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
难度: 困难查看答案及解析
-
常温下,将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是( )
A.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+) B.c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
C.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) D.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
难度: 中等查看答案及解析
-
将AgCl分别加入盛有:①5 mL水;②6 mL0.5mol/L NaCl溶液;③10 mL 0.2 mol/LCaCl2溶液;④50 mL0.1mol/L盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是 ( )
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO
,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO
B.CrO
、Br、Cl-
C.Br-、Cl-、CrO
D.Br、CrO
、Cl-
难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s)
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
难度: 困难查看答案及解析
-
常温下,若1体积硫酸恰好与2体积pH=11的氢氧化钠溶液混合后pH=3(混合后体积变化不计)则二者物质的量浓度之比应为( )
A. 5︰1 B. 5︰2 C. 1︰5 D. 2︰5
难度: 中等查看答案及解析
-
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g)ΔH<0,则下列叙述不正确的是( )
A.该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以反应前后物质具有的总能量不变
B.上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C.该反应的化学能可以转化为其他形式的能
D.反应物的总能量高于生成物的总能量
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
根据热化学方程式S(l)+O2(g)═SO2(g)△H=﹣293.23kJ·mol﹣1,分析下列说法中正确的是( )
A.1mol固体S单质燃烧放出的热量大于293.23 kJ
B.1mol气体S单质燃烧放出的热量小于293.23 kJ
C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和
D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和
难度: 简单查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ•mlo-1、-1411.0kJ•mlo-1和-13
66.8kJ,( C2H4 、C2H5OH(1)充分燃烧后的产物为CO2和H2O)则由C2H4(g)和H2O(I)反应生成C2H5OH(1)的△H为( )
A.-44.2kJ•mol-1 B.+44.2kJ•mlo-1 C.-330kJ•mol-1 D.+330kJ•mlo-1
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D 使用催化剂降低活化能,但活化分子数,活化分子百分数不变
难度: 中等查看答案及解析
-
一密闭体系中发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,下图是某一时间段中反应速率与反应时间的曲线关系图,则t1时刻采用的条件( )

A 增大压强 B 减小压强 C 升高温度 D
降低温度
难度: 中等查看答案及解析
