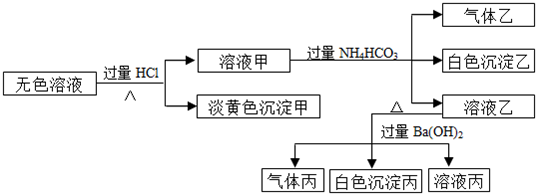
-
常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强.
A.①③⑤⑥
B.①③④
C.②④⑥
D.②⑤难度: 中等查看答案及解析
-
某物质经分析知,其中仅含一种元素,此物质( )
A.可能是纯净物也可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质难度: 中等查看答案及解析
-
实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500mL水
B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾配成500mL溶液难度: 中等查看答案及解析
-
下列类型的反应,一定发生电子转移的是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应难度: 中等查看答案及解析
-
下列推断合理的是( )
A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色难度: 中等查看答案及解析
-
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A.10mol
B.11mol
C.12mol
D.13mol难度: 中等查看答案及解析
-
溶液、胶体和悬浊液这三种分散系的本质区别是( )
A.是否为大量分子或离子的集合体
B.能否透过滤纸或半透膜
C.分散质粒子的大小
D.能否产生丁达尔现象难度: 中等查看答案及解析
-
下列对合金的说法正确的是( )
A.合金中至少含有两种金属元素
B.合金中的金属元素以化合物的形式存在
C.黄铜是纯净物
D.合金中也可含非金属元素难度: 中等查看答案及解析
-
下列物质能导电且属于电解质的是( )
A.石墨
B.NaCl溶液
C.氯化钠固体
D.熔融的NaOH难度: 中等查看答案及解析
-
下列有关实验操作或叙述中,不正确的是( )
A.用酸式滴定管量取25.00ml 1mol/L的酸性高锰酸钾溶液
B.配制一定物质的量浓度的氢氧化钠溶液,定容时俯视刻度线,结果将偏高
C.浓硝酸保存在无色试剂瓶中,氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入浓硝酸中,并不断搅拌难度: 中等查看答案及解析
-
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L难度: 中等查看答案及解析
-
把100g浓度为18mol•L-1、密度为ρ的浓硫酸加到一定量的水中稀释成9mol•L-1的硫酸,则加入水的体积( )
A.小于100mL
B.等于100mL
C.大于100mL
D.等于100/ρmL难度: 中等查看答案及解析
-
相对分子质量为a的某物质在室温下的溶解度为bg,此时测得饱和溶液的密度为c g•cm-3,则该饱和溶液的物质的量浓度是
( )
A.mol•L-1
B.mol•L-1
C.mol•L-1
D.mol•L-1
难度: 中等查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸③苯酚钠溶液与CO2 ④硝酸银溶液与氨水
⑤氯化铝溶液与氨水 ⑥碳酸氢钠溶液与澄清的石灰水.
A.③⑤
B.①③⑥
C.仅有⑤
D.②④难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓
B.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.Ba(OH)2溶液中滴入NaHSO4至pH等于7:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.KHS的水解 HS-+H2O⇌H2S+OH-难度: 中等查看答案及解析
-
用如图表示的一些物质或概念间的从属关系中不正确的是( )
X Y Z 例 氧化物 化合物 纯净物 A 苯的同系物 芳香烃 芳香族化合物 B 胶体 分散系 混合物 C 电解质 离子化合物 化合物 D 碱性氧化物 金属氧化物 氧化物 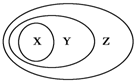
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
一定能在指定环境中大量共存的是( )
A.c(H+)=1×10-2mol/L的溶液:Na+、NH4+、CO32-、SO42-
B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe3+、ClO-、Na+、SO42-
C.在pH=1的溶液中,NO3-、SO42-、Na+、Fe2+
D.含有大量SO42-溶液:K+、Cu2+、Cl-、NO3-难度: 中等查看答案及解析
-
下列化学方程式或离子方程式书写正确是( )
A.2Na218O2+2H2O═4Na18OH+O2↑
B.用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O
C.向含KIO3与KI的混合溶液中加食醋酸化:IO3-+5I-+6H+═3I2+3H2O
D.向Na2SO3溶液中通入氯气:SO32-+Cl2+H2O═SO42-+2Cl-+2H+难度: 中等查看答案及解析
-
只用一种试剂即可区别的:NaCl、MgCl2、FeCl3、Al2(SO4)3四种溶液,这种试剂是( )
A.AgNO3
B.NaOH
C.BaCl2
D.HCl难度: 中等查看答案及解析
-
除去下列物质中所含少量杂质的方法正确的是( )
选项 物质 杂质 试剂 提纯方法 A BaSO4 BaCO3 水 溶解、过滤、洗涤 B CO2 SO2 饱和Na2CO3溶液 洗气 C 乙酸乙酯 乙酸 稀NaOH溶液 混合振荡静置分液 D 蛋白质 葡萄糖 浓(NH4)2SO4溶液 盐析、过滤、洗涤
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在同温同压下,某空瓶充满O2后的质量为116g,充满CO2后的质量为122g,充满气体X后的质量为114g,则X的相对分子质量为( )
A.28
B.60
C.32
D.44难度: 中等查看答案及解析
-
将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g•mL-1,该溶液的溶质质量分数为( )
A.%
B.%
C.%
D.%
难度: 中等查看答案及解析
-
下列实验操作中,仪器末端插入溶液液面以下的是( )
①用水吸收氨气时的导气管
②制备氢气的简易装置中的长颈漏斗
③用NaOH溶液和新制FeSO4溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管
④用乙醇制备乙烯时所用的温度计
⑤分馏石油时测量温度所用的温度计.
A.②⑤
B.②③⑤
C.②③④
D.①②③④⑤难度: 中等查看答案及解析
-
鉴别固体Na2CO3和NaHCO3,下列方法可行的是( )
A.分别配成溶液,再加入澄清石灰水
B.分别配成溶液,再加入氢氧化钠溶液
C.分别加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别配成溶液,再进行焰色反应难度: 中等查看答案及解析