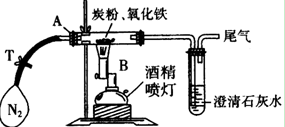
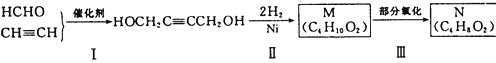-
下列化学与生活知识中叙述正确的是( )
A.硅是一种重要的半导体材料,可作光导纤维
B.甲醛是某些劣质装饰板材释放的常见污染物之一
C.酸雨是指pH<7的雨水,主要由于空气中SO2含量偏高引起
D.臭氧空洞的形成与二氧化碳的过量排放有关
难度: 中等查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
① 根据酸分子中含氢原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.①② B.②④ C.②⑤ D.④⑤
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,则下列说法中正确的是( )
A.加热条件下,1mol Cl2与足量Fe粉充分反应,转移的电子数为3NA
B.常温常压下,14g N2所含的原子数目为NA
C.常温下,1mol/L (NH4)2SO4溶液中含SO42-数为NA
D.标准状况下,2.24L H2O中含有的电子数为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式中正确的是( )
A.钠与水反应: Na+2H2O = Na+ +2OH-+H2↑
B.氢氧化钡溶液和硫酸铵溶液混合:Ba2++ SO42- = BaSO4↓
C.硫化钠溶于水呈碱性:S2- + H2O
HS- + OH-
D.向溴化亚铁溶液中通入少量氯气:Cl2+2Br-=2Cl-+Br2
难度: 中等查看答案及解析
-
在下列各组离子中,能在同一溶液中大量共存的是( )
A. K+、AlO2-、SO42-、HCO3- B. K+、H+、NO3-、Fe2+
C. Na+、CO32-、Cl-、Ca2+ D. Na+、Cl-、SO42-、H+
难度: 中等查看答案及解析
-
如右图所示,a、b是两根石墨棒,下列叙述正确的是( )

A.a是正极,发生还原反应,b是阴极,发生还原反应
B.装置工作时,稀硫酸溶液中C(H+)变小、C(Cu2+)变大
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
难度: 中等查看答案及解析
-
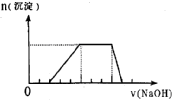
25℃时,将0.1mol·L-1的某碱MOH溶液与某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )
A.HA溶液的pH值一定为1 B.盐MA不能水解
C.HA物质的量浓度一定为0.1 mol·L-1 D.混合后的溶液中c(M+)一定等于c(A-)
难度: 中等查看答案及解析
-
同温同压下两个容积相等的贮气瓶,一个装有NO气体,另一个装有O2和N2的混合气体,
则两瓶内的气体不一定相同的是 ( )
A.气体质量 B.气体的物质的量 C.分子总数 D.原子数
难度: 中等查看答案及解析
-
下列溶液:①硝酸钡溶液 ②碘水 ③酸性高锰酸钾溶液 ④氯化铁溶液 ⑤品红溶液,其中能用来区别SO2和CO2气体的是( )
A.③⑤ B.②③⑤ C.①②③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
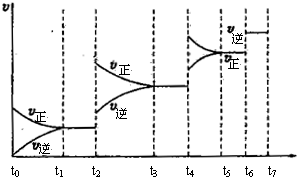
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④ C.①② D.①④
难度: 中等查看答案及解析
-
关于3Cl2 + 6KOH
KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
A.Cl2是氧化剂,KOH是还原剂
B.被氧化的氯元素的质量为被还原的氯元素质量的5倍
C.3mol氯气参加反应转移10mol电子
D.KOH既不是氧化剂,又不是还原剂
难度: 中等查看答案及解析
-
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
难度: 中等查看答案及解析
-
下列实验操作中错误的是 ( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.测pH值时,应用玻璃棒蘸取待测液滴于湿润pH试纸中部,再与标准比色卡对比
D.称量时,称量物放置于托盘天平的左盘,砝码放在托盘天平的右盘
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )
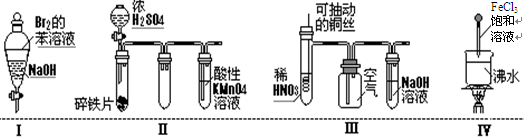
A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明
B.实验Ⅱ:铁片最终完全溶解,且高锰酸钾溶液变无色
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象
难度: 中等查看答案及解析
-
维生素E是一种脂溶性维生素,有抗衰老的特殊作用。维生素E有四种类型,其结构简式如图所示[R为(CH2)3CH(CH3)(CH2)3CH(CH3)(CH2)3CH(CH3)2]。

下列说法中,正确的是( )
A.四种维生素E均能与烧碱溶液反应 B.四种维生素E均能与溴水反应
C.四种维生素E互为同分异构体 D.四种维生素E均能在稀硫酸中水解
难度: 中等查看答案及解析
-
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、
CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是( )
A.依据电荷守恒,推测一定存在K+和NH4+ B.100mL溶液中含0.01mol CO32-
C.Ba2+一定不存在,Mg2+可能存在 D. 2.33g沉淀中含BaCO3和BaSO4
难度: 中等查看答案及解析
-
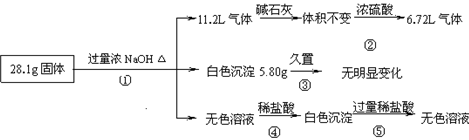
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),下列说法正确的是 ( )
A.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含AlCl3、FeCl2
B.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含FeCl2 ,不能确定是否含有AlCl3
C.所有物质是否存在均能确定,不存在无法确定的物质
D.混合物中一定含有Al、(NH4)2SO4、MgCl2 和AlCl3,一定不含FeCl2
难度: 中等查看答案及解析
-
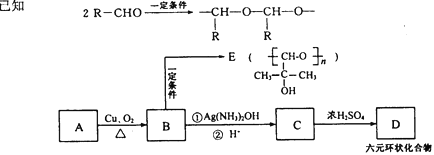
甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们。根据下图中的转化关系,下列判断错误的是( )

A.甲是BaCl2 B.丙是Ba(NO3)2 C.戊是Na2SO4 D.X是Na2CO3
难度: 中等查看答案及解析