-
日常生活中遇到的很多问题都涉及化学知识,下列有关叙述不正确的是
A. Al2O3熔点高,可用作耐高温材料
B. 用米汤检验含碘盐中的碘酸钾
C. 用纯碱溶液洗涤餐具上的油污
D. 利用丁达尔效应区别蛋白质溶液和食盐水
难度: 简单查看答案及解析
-
下列说法中,正确的是
A. 强电解质的水溶液一定比弱电解质溶液的导电能力强
B. 强电解质都是离子化合物,弱电解质都是共价化合物
C. 强电解质的水溶液中不存在溶质分子
D. 不溶性盐都是弱电解质,可溶性酸和具有极性键的化合物都是强电解质
难度: 中等查看答案及解析
-
甲酸的下列性质中,可以证明它是弱电解质的是( )
A. 1 mol·L-1的甲酸溶液中c(H+)约为1×10-2 mol/L
B. 甲酸能与水以任意比例互溶
C. 甲酸与盐酸都能与NaOH发生反应
D. 甲酸溶液的导电能力比盐酸溶液的导电能力弱
难度: 简单查看答案及解析
-
同时符合下列条件的物质是属于非电解质溶于水时化学键被破坏水溶液能导电( )
A. 碳酸钠 B. 乙醇 C. 氨气 D. 氯气
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中,能大量共存的是( )
A. c(H+)=0.1 mol·L-1的溶液:Na+、NH、SO
、S2O
B. 与铝粉反应放出H2的无色溶液:NO、Al3+、Na+、SO
C. 中性溶液:Fe3+、Al3+、NO、SO
D. 常温下c(H+)/c(OH-)=1×10-12的溶液:K+、AlO、CO
、Na+
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 向CuSO4溶液中投入Na:Cu2++2Na===Cu+2Na+
B. 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-===Fe(SCN)3↓
C. 过量Ca(OH)2溶液和NaHCO3溶液反应 Ca2++OH-+HCO===CaCO3↓+H2O
D. 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+===Ba2++CO2↑+H2O
难度: 中等查看答案及解析
-
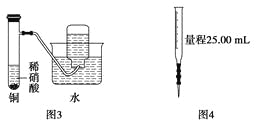
下图所示的实验装置不能完成实验目的是( )
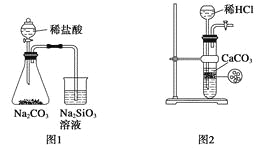
A. 图1为证明非金属性强弱:Cl>C>Si
B. 图2为制备少量CO2并控制反应
C. 图3为制备并收集少量NO气体
D. 图4量取0.10 mol·L-1KOH溶液20.00 mL
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.由2H和18O所组成的水11 g,所含的中子数为4NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
D.NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
难度: 困难查看答案及解析
-
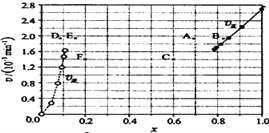
常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )

A. HA为强酸 B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+) D. 图中X表示HA,Y表示OH-,Z表示H+
难度: 中等查看答案及解析
-
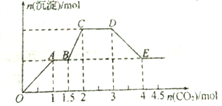
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
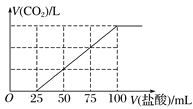
下列判断正确的是( )
A. 通入CO2在标准状况下的体积为448 mL
B. 原NaOH溶液的浓度为0.2 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
难度: 中等查看答案及解析
-
某溶液中可能存在Br-、CO
、SO
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是( )
A. Al3+、Mg2+、SO
B. Mg2+、CO
、I-
C. Al3+、SO
、I- D. Al3+、Br-、SO
难度: 困难查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知N2(g)+3H2(g)
2NH3(g)ΔH=-92.4 kJ·mol-1.下列说法正确的是( )
容器
甲
乙
丙
反应物投入量
1 mol N2、3 mol H2
2 mol NH3
4 mol NH3
NH3的浓度
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
A. 2c1 = c3 B. a+b = 92.4 C. 2p2 = p3 D. α1+α3 = 1
难度: 困难查看答案及解析
-
下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
难度: 中等查看答案及解析
-
A. 锥形瓶里溶液在滴定过程中溅出
B. 滴定管装液后尖嘴部位有气泡,滴定后气泡消失
C. 指示剂变色15s后又恢复为原来的颜色便停止滴定
D. 锥形瓶用蒸馏水冲洗后未用待测液润洗
难度: 中等查看答案及解析
-
室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应.下列关于反应后溶液pH的判断,正确的是( )
A. 若x=y,且a+b=14,则pH>7 B. 若10x=y,且a+b=13,则pH=7
C. 若ax=by,且a+b=13,则pH=7 D. 若x=10y,且a+b=14,则pH>7
难度: 中等查看答案及解析
-
用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL。若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL)。则①和②pH之差为( )
A. 2 B. 4 C. 6 D. 8
难度: 中等查看答案及解析
-
常温下,向0.25mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
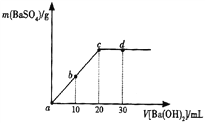
A. 硫酸溶液的体积为25 m L
B. b时刻溶液中SO
的浓度约为0.125 mol·L-1
C. d时刻溶液的pH为12
D. 溶液的导电能力:c<d<b<a
难度: 困难查看答案及解析
-
现有室温下四种溶液,有关叙述正确的是( )
编号
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:④>③
B. 分别加水稀释10倍,四种溶液的pH①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(H+)>c(OH-)
D. Va L ④溶液与Vb L ②溶液混合(混合液体积=Va + Vb)若混合溶液pH = 5,则Va :Vb =9 :11
难度: 中等查看答案及解析
-
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg
的变化如图所示。下列叙述错误的是
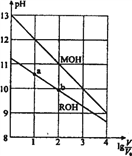
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg
=2时,若两溶液同时升高温度,则
增大
难度: 困难查看答案及解析
-
取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g ,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A.3.2mol/L B.1.6mol/L C.0.9mol/L D.无法判断
难度: 困难查看答案及解析