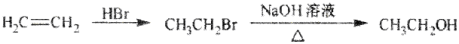-
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
A.蔬菜表面洒少许福尔马林,可保鲜和消毒
B.推广使用可降解塑料及布质购物袋,以减少“白色污染”
C.绿色食品就是不使用化肥农药,不含任何化学物质的食品
D.推广使用煤液化技术可减少二氧化碳温室气体的排放
难度: 简单查看答案及解析
-
化学学科需要借助化学语言来描述。下列化学用语正确的是
A.甲烷分子的球棍模型:
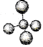
B.NH4Br的电子式:

C.氯原子的结构示意图:
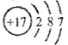
D.邻羟基苯甲酸的结构简式:
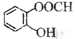
难度: 中等查看答案及解析
-
下列说法正确的是
A.126C、136C、146C三种核素互为同素异形体
B.
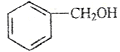 和
和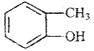 的分子式相同,化学性质也相同
的分子式相同,化学性质也相同C.等质量的甲烷按a,b两种途径完全转化,途径a比途径b消耗更多的O2
途径a:
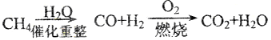 ;途径b:
;途径b: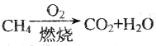
D.铝热反应实验说明:在一定条件下铝的还原性强于很多难熔金属
难度: 中等查看答案及解析
-
下列有关物质的性质或应用均正确的是
A.二氧化硅为酸性氧化物,可用于制做计算机芯片
B.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
D.浓硫酸具有脱水性,可用于干燥NH3、SO2等
难度: 中等查看答案及解析
-
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A.Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3-
C.c(Fe3+)=0.1 mol/L的溶液:Fe2+、Al3+、Cl-,CO32-
D.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
难度: 中等查看答案及解析
-
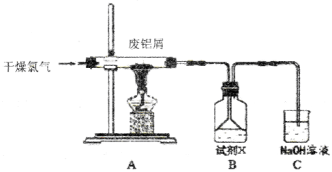
用下列实验装置和方法进行相应实验,能达到实验目的的是
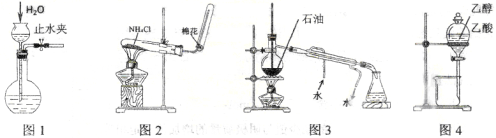
A.用图1所示方法检查装置的气密性
B.用图2所示装置制取氨气
C.用图3所示装置进行石油分馏
D.用图4所示装置分离乙醇与乙酸
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,Y元素原子最外层电子数等于其电子层数,W是同周期中原子半径最小的元素。下列叙述正确的是
A.Y的简单离子半径小于W的简单离子半径
B.W、X形成的化合物为离子化合物
C.X的最高价氧化物对应的水化物的酸性比W的强
D.Z的气态简单氢化物的稳定性比X的强
难度: 中等查看答案及解析
-
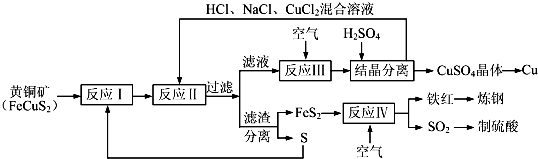
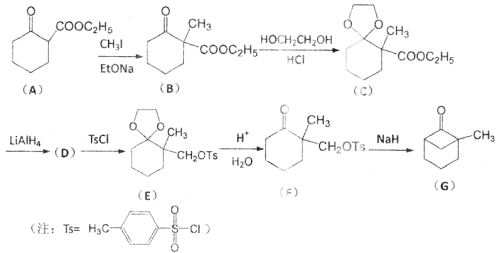
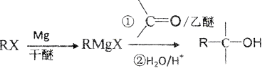
下列物质的转化在给定条件下不能实现的是
A.
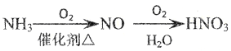
B.
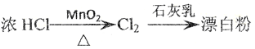
C.
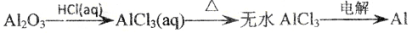
D.

难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是
A.Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将过量SO2气体通入氨水中:SO2 + NH3·H2O =NH4++ HSO3-
C.用醋酸除去水垢中的CaCO3 : CaCO3 + 2 H+=Ca2++ H2O+CO2↑
D.用KIO3氧化酸性溶液中的KI: 5I-+IO3- +3H2O=3I2+6OH-
难度: 简单查看答案及解析
-
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是
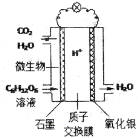
A.氧化银电极上反应为:Ag2O+2e-= 2Ag +O2-
B.石墨电极上反应为:C6H12O6+6H2O +24e-= 6CO2↑+24H+
C.每转移4mo1电子,氧化银电极产生22.4LCO2气体(标准状况)
D.每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.某温度下,1L pH=8的纯水中含OH-为10 -6rnol
B.电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等
C.合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率
D.CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(OH-)的值减小
难度: 简单查看答案及解析
-
β-紫罗兰酮是存在于玫瑰花、番茄等中的一种大然香料,它经多步反应可合成维生素Al。
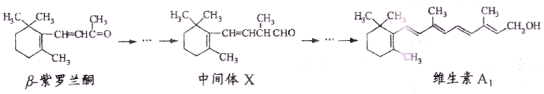
下列说法正确的是
A.β一紫罗兰酮可使酸性KMnO4溶液褪色
B.1mol中间体X最多能与3mo1H2发生加成反应
C.维生素Al易溶于NaOH溶液
D.β一紫罗兰酮与中间体X互为同系物
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向硅酸钠溶液中滴加盐酸
有白色胶状沉淀生成
非金属性:C1>Si
B
向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中
生成白色沉淀
溶液X中一定含有CO32-或HCO3-
C
蔗糖溶液在硫酸存在下加热一段时间后,再与银氨溶液混合水浴加热
无银镜出现
蔗糖没有水解
D
向鸡蛋白溶液中滴入HgCl2溶液
有白色沉淀
蛋白质发生盐析
难度: 中等查看答案及解析
-
常温下,下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol/LCH3COONa溶液与0.1 mol/LCaC12溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl- )
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O)
C.0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-)
D.0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)=c(NH3·H2O)+c(OH-)
难度: 困难查看答案及解析
-
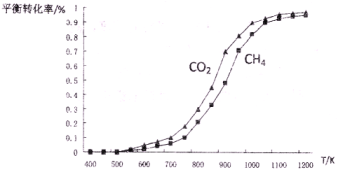
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1 <t2),下列说法正确的是

A.反应在t1 min内的平均速率为v(H2)=0.40/t1moI/(L·min)
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2,到达平衡时,n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol CO,与原平衡相比,达到新平衡时CO转化率减小,H2O的体积分数也减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
难度: 困难查看答案及解析