-
化学与生活密切相关,下列说法不正确的是
A. 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉辨别真假葡萄酒
B. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
C. 金属的防护中,牺牲阳极的阴极保护法利用的是原电池原理
D. “84”消毒液在日常生活中使用广泛,其有效成份为Ca(ClO)2
难度: 中等查看答案及解析
-
氢化钙固体是登山运动员常用的能源供给剂。在实验室中可以用金属钙和氢气加热反应制取。下列说法正确的是
A.氢化钙是一种强氧化剂
B.加热时,氢化钙能跟干燥的氧气反应生成水
C.氢化钙(CaH2)是离子化合物,固体中含有H-H键
D.可以取少量式样滴加几滴水,检验反应是否产生氢气来区别金属钙和氢化钙
难度: 中等查看答案及解析
-
下表中各栏目的叙述对应都正确的一项是
选项
叙述
实验现象
解释
A
反萃取法提取碘的CCl4溶液中的碘
向富碘的CCl4溶液中加入足量水、振荡、静置、分液
碘在水中溶解度比在CCl4中大
B
在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液
产生蓝色沉淀
2Fe3+ + Fe = 3Fe2+
3Fe2+ + 2[Fe(CN)6]3—=
Fe3[Fe(CN)6]2↓
C
向0.1mol/L的Fe(NO3)2溶液中滴加盐酸
振荡试管颜色加深
H+抑制Fe2+水解
D
让蛋白质从水溶液中析出
将CuSO4溶液加入蛋白质中发生盐析
重金属无机盐溶液可降低蛋白质的溶解度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
核黄素又称维生素B,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

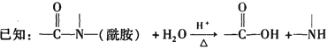
有关核黄素的下列说法中,正确的是
A.该物质属于有机高分子
B.不能发生酯化反应
C.不能与氢气发生加成反应
D.酸性条件下加热水解,有CO2生成
难度: 中等查看答案及解析
-
Li—Al/FeS电池是某科研机构正在研发的一种车载电池,该电池中正极的电极反应式为:2Li++FeS+2e—==Li2S+Fe。有关该电池的下列说法正确的是
A. Li—Al在电池中作为负极材料,该材料中Li的化合价为+l价
B. 用水作电解质溶液
C. 该电池的电池反应式为:2Li+FeS== Li2S+Fe
D. 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-==2Li++FeS
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,Y原子的最外层电子数是内层电子数的3倍。而Z不能形成双原子分子。
下列说法正确的是
A. W、X、Y、Z原子的核外最外层电子数的总和为19
B. W的阴离子半径小于Li
C. W与Y可形成既含共价键又含离子键的化合物
D. X、Y的简单气态氢化物的稳定性:X>Y
难度: 中等查看答案及解析
-
已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
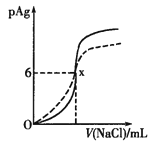
A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol
L-1的NaCl溶液换成0.1mol
L-1的NaI溶液则图像变为虚线部分
难度: 困难查看答案及解析


 用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。