-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是 ( )
A. 原子半径由大到小的顺序为:Y > Z > X
B. Y元素最高价氧化物对应的水化物化学式H2YO4
C. Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D. X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及实验现象
结论
A
室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去
溶液中含有Fe2+,不含Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊
Na2O2已经变质
D
向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀
Ksp(AgCl)<Ksp(Ag2CrO4)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
下列说法正确的是
①1L0.1mol/LNH4NO3溶液中氮原子数小于0.2NA
②用标准盐酸滴定NaOH 溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
③PH相等的四种溶液: a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH。(已知酸性:C6H5OH2CO3),其溶液物质的量浓度由小到大顺序为:d、b、c、a
④钢铁腐蚀时可能发生的正极反应: 2H2O+O2+4e-=4OH-
⑤电解饱和MgCl2溶液时,电解反应式为:2H2O+2Cl-
Cl2↑+H2↑+2OH-
⑥在海轮外壳连接锌块保护外壳不受腐蚀是采用牺牲阳极的阴极保护法
⑦长期使用硫酸铵,土壤酸性增强:草木灰与铵态氮肥不能混合施用
A. ①②⑤⑥ B. ①③⑤⑦ C. ②③④⑤ D. ③④⑥⑦
难度: 中等查看答案及解析
-
如图表示某种有机物的结构,关于它的性质叙述中正确的是

A. 1mol该有机物在一定条件下,能与7molH2发生加成反应
B. 能与NaHCO3反应放出气体
C. 不能与FeCl3溶液作用发生显色反应
D. 1mol该有机物在一定条件下,能与7molNaOH反应
难度: 中等查看答案及解析
-
高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析
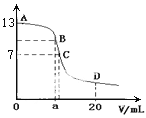
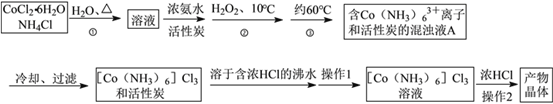

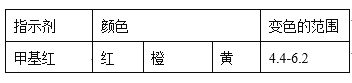

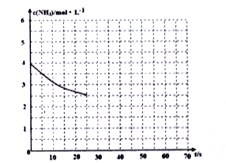
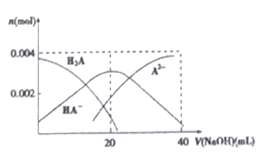
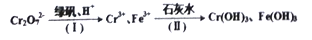
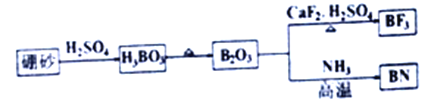

 是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到
是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到 的变化过程._____________
的变化过程._____________