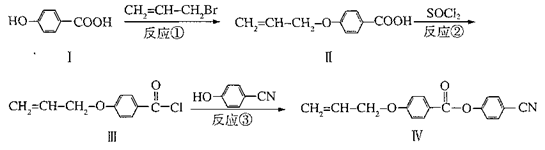
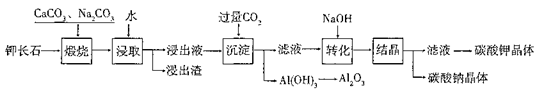
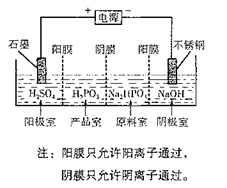
-
在水溶液中能大量共存的一组离子是
A.Al3+、Na+、HCO3-、SO42- B.H+、Fe2+、ClO-、Cl-
C.Mg2+、K+、SO42-、NO3- D.NH4+、Ag+、OH-、Br-
难度: 中等查看答案及解析
-
下列说法正确的是
A.食盐、醋酸和蔗糖都是电解质
B.纤维素、淀粉和蛋白质都是高分子化合物
C.甲烷和乙烯均可使酸性KMnO4溶液褪色
D.乙酸乙酯和植物油均可水解生成乙醇
难度: 中等查看答案及解析
-
下列实验不能达到目的的是
A.用AlCl3溶液和过量氨水制备Al(OH)3
B.用NH4Cl和Ca(OH) 2固体混合加热制备NH3
C.用NaOH溶液除去苯中的溴
D.用足量铜粉除去FeCl2溶液中的FeCl3杂质
难度: 简单查看答案及解析
-
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.16g CH4含有10nA个电子
B.常温常压下,22. 4L Cl2含有2nA个Cl原子
C.1 mol Cu与足量稀HNO3反应,转移3nA个电子
D.1L 0.1 mol•L-1 Na2SO3 溶液中含有 0. 1nA个SO32-
难度: 简单查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项 陈述I 陈述II
A 浓H2SO4有吸水性 浓H2SO4可用于干燥氨气
B SO2有氧化性 SO2尾气可用NaOH溶液吸收
C Mg有还原性 电解MgCl2饱和溶液可制备Mg
D 锌金属活动性比铁强 海轮外壳上装锌块可减缓腐蚀
难度: 简单查看答案及解析
-
对于常温下pH= 3的乙酸溶液,下列说法正确的是
A.c(H+)=c(CH3COO-)+c(OH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH降低
D.与等体积pH=11的NaOH溶液混合后所得溶液中c(Na+)=c(CH3COO-)
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三 倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族,则
A.原子半径:Y< Z < W
B.单质的还原性:Y> Z
C.气态氢化物的稳定性:X>W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 简单查看答案及解析
-
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是

A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0–t1 min内CH3OH的平均生成速率为
mol•L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时
减小
难度: 简单查看答案及解析