-
中国古代科学著作《天工开物》中有言:“世间丝、麻、裘、褐皆具素质”,那么“裘”的主要成分是
A. 油脂 B. 维生素 C. 纤维系 D. 蛋白质
难度: 简单查看答案及解析
-
《本草纲目》中对白矾之用有如下叙述:“吐利风热之痰涎,取其酸苦涌泄也;治诸血痛,脱肛……取其酸涩而收也………下列说法错误的是
A. 治血痛的原因是利用了胶体的聚沉
B. 白矾溶于水后微粒浓度排序: c (H2O)>c (SO42-) >c (Al3+) >c (K+) >c(OH-)>c(H+)
C. 检测“无矾油条”是否含“矾”的方法是: 将油条加热碳化→加水溶解→过滤→滤液中逐滴加入NaOH 溶液
D. 白矾在油条中做膨化剂的原理是: A13++ 3HCO3-= Al(OH)3↓+3CO2↑
难度: 中等查看答案及解析
-
曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可继续使用,其结构如图所示,下列说法不正确的是

A. 1mol 的草甘膦可以与3mol 的NaOH中和
B. 分子式为C3H8NO5P
C. 可以溶于水
D. 属于酯类的同分异构体只有两种
难度: 困难查看答案及解析
-
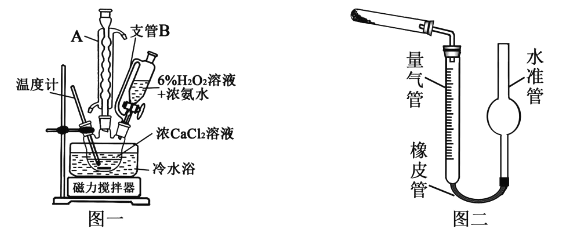
亚硝酸钠(NaNO3)是工业盐的主要成分,在漂白、电镀等方面应用广泛。己知: 室温下,2NO+Na2O2= =2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(部分夹持装置已略去)下列说法正确的是
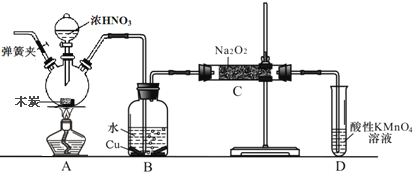
A. 实验开始前先向装置中通入N2,实验结束时先停止通入N2再熄灭酒精灯
B. 可以将B中药品换成NaOH 溶液
C. 应在B、C之间加一个盛放碱石灰的干燥管
D. D装置用于尾气处理,标况下,每吸收11.2L的尾气消耗0.2mol 的高锰酸钾
难度: 困难查看答案及解析
-
2005 年,法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车顶采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成五层中膜材料(如下图所示)。其工作原理是: 在外接电源(外加电场) 下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节,下列有关说法不正确的是

A. 当A接外接电源负极时,电致变色层发生反应为: WO3+Li++e-= LiWO3
B. 当A接外接电源正极时,Li+脱离离子存储层
C. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
D. 当B接外接电源正极时,膜的透射率降低,可以有效阻挡阳光
难度: 困难查看答案及解析
-
短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份滴加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是
A. R、X 可以形成X2R4,电子式为
B. 气态氢化物的稳定性: XH3>H2Y>H2T
C. Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂
D. M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
难度: 中等查看答案及解析
-
常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
难度: 困难查看答案及解析