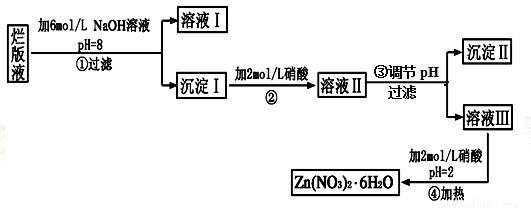
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
A.c(Ba2+)=c(SO42-)
B.c(Ba2+)增大,c(SO42-)减小
C.c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=Ksp(BaSO4)
D.c(Ba2+)≠c(SO),c(Ba2+)· c(SO42-)≠Ksp(BaSO4)
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42- B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42- D.Br-、CrO42-、Cl-
难度: 困难查看答案及解析
-
向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度(I)随加入氨水的体积(V)变化的曲线关系是下图中的
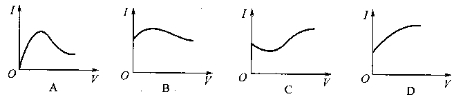
难度: 中等查看答案及解析
-
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O
H3O++CO32-
B.NH4++H2O
NH3·H2O+OH-
C.PO43-+H2O
HPO42-+OH-
D.H2O+H2O
H3O++OH-
难度: 中等查看答案及解析
-
对于xA(g)+yB(g)
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是
A.x+y>z+w, 正反应是放热反应 B.x+y>z+w,正反应是吸热反应
C.x+y<z+w,逆反应是放热反应 D.x+y<z+w,正反应是吸热反应
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw增大
C.降温,使平衡左移,c(H+)减小,溶液呈碱性
D.将水加热,Kw增大,pH减小
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
在某温度下,0.01 mol·L-1 NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是
A.由水电离出的c(H+)相等
B.由水电离出的c(H+)都是1.0×10-12 mol·L-1
C.由水电离出的c(OH-)都是0.01 mol·L-1
D.两者都促进了水的电离
难度: 中等查看答案及解析
-
H+浓度都为0.01mol/L的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是
A. 醋酸与锌反应放出氢气多
B. 盐酸与锌反应放出氢气多
C. 醋酸与锌反应速率大
D. 盐酸和醋酸分别与锌反应速率一样大
难度: 中等查看答案及解析
-
液氨与水的电离相似,存在微弱的电离:NH3+NH3
NH4++NH2-。对该体系的说法中错误的是
A.液氨中c(NH4+)与c(NH2—)的乘积为一常数
B.液氨电离达到各微粒的浓度保持不变
C.只要不加入其它物质c(NH4+)=c(NH2-)
D.液氨中存在NH3、NH4+、NH2-、H2O、NH3·H2O等粒子。
难度: 困难查看答案及解析
-
室温下,某氨水pH=x,某盐酸pH=y,已知x+y=14,且x>11。将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序正确的是
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)= c(NH4+)>c(OH-)=c(H+)
D.c(Cl-)= c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1molHY酸,需要的NaOH小于1mol
难度: 中等查看答案及解析
-
室温下,有关叙述正确的是
A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)> c(CH3COO-)
难度: 中等查看答案及解析
-
室温下,0.1 mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH溶液,在滴加过程中,有关叙述正确的是
A.原HA溶液中,c(H+)=c(OH-)+c(A-)
B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低
C.当恰好完全中和时,溶液呈中性
D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
室温下,下列叙述正确的是
A.在醋酸溶液的pH=a,将此溶液稀释1倍后溶液的pH=b,则a>b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1×10-3 mol/L盐酸的pH=3.0,1×10-8 mol·L-1盐酸的pH=8.0
D.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
难度: 中等查看答案及解析
-
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是
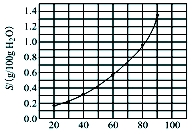
A.溴酸银的溶解是吸热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-3
D.若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离
难度: 困难查看答案及解析
-
已知298K时,Mg(OH)2的溶度积常数为KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中c(H+)=10-13 mol/L
B.所加烧碱溶液的pH=13.0
C.所得溶液中由水电离产生的c(OH-)=10-13 mol/L
D.所得溶液中c(Mg2+)=5.6×10-10 mol/L
难度: 困难查看答案及解析
-
Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
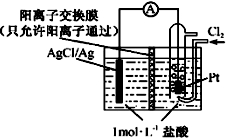
A.正极反应为Cl2+2e-=2Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子
难度: 困难查看答案及解析