-
酸碱恰好完全中和时( )
A.酸与碱的物质的量一定相等
B.溶液呈现中性
C.酸与碱的物质的量浓度相等
D.酸所能提供的H+与碱所能提供的OH-的物质的量相等
难度: 简单查看答案及解析
-
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4
石蕊:5.0~8.0
酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
难度: 中等查看答案及解析
-
某学生用碱式滴定管量取0.1 mol·L-1的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
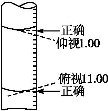
A.大于10.00 mL B.小于10.00 mL
C.等于10.00 mL D.等于11.00 mL
难度: 中等查看答案及解析
-
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
A.V1>V2>V3 B.V1<V2<V3
C.V1=V2>V3 D.V1=V2<V3
难度: 中等查看答案及解析
-
用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
A.4 B.7.2 C.10 D.11.3
难度: 中等查看答案及解析
-
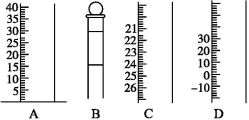
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )

A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL
难度: 中等查看答案及解析
-
中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者的大小关系为( )
A.V3>V2>V1 B.V3>V2=V1
C.V3=V2>V1 D.V1=V2>V3
难度: 中等查看答案及解析