-
下列有关化学方应方向的说法中正确的是
A.凡是焓变小于零的反应都能自发进行
B.凡是熵变小于零的化学反应都能自发进行
C.凡是焓变小于零,熵变大于零的化学变化都能自发进行
D.CaCO3在高温下的分解反应不属于自发过程
难度: 中等查看答案及解析
-
在体积可变的容器中发生反应N2 + 3H2
2NH3,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
难度: 中等查看答案及解析
-
现有100g3.4%的氨水,欲使其质量分数(NH3)增大1倍,可采用的正确方法是
A.使溶液再溶解0.2molNH3 B.加入20.4%的浓氨水25g
C.加热蒸发掉一半水 D.加热蒸发掉50gH2O
难度: 中等查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g) △H =-72 kJ·mol-1 ,蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
H2 (g)
Br2 (l)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量kJ
436
a
369
则表中a为
A.404 B.260 C.230 D.200
难度: 中等查看答案及解析
-
一定温度下的恒容容器中,能标志某可逆反应A(s)+2B(g)
C(g)+D(g)已达平衡状态的是
A.混合气体的压强不随时间变化而变化
B.气体总物质的量不随时间变化而变化
C. v (B)正=v (D)逆
D.单位时间内消耗n mol C,同时消耗2nmol B
难度: 中等查看答案及解析
-
在其他条件一定时,对反应2A+B
2C(正反应放热),A的最大转化率与温度曲线如右图,下列叙述正确的是
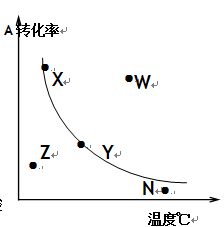
A.X或Y两点相应的V正≠V逆
B.X、Y两点均已到达平衡状态两点的反应速率均有V正=V逆C.W点表示非平衡状态且V正>V逆
D.相应点的反应速率大小:W>N>Y
难度: 中等查看答案及解析
-
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq)
H++In-(aq)
(红色) (黄色)
浓度为0.02mol/L的下列各溶液:
(1)HCl (2)石灰水 (3)NaCl(aq) (4)NaHSO4(aq) (5)NaHCO3(aq) (6)氨水 (7)Na2O2 粉末 ;其中能使指示剂显黄色的是
A. (1)(4)(5) B. (2)(5)(6)
C. (1)(4) D. (2)(5)(6)(7)
难度: 中等查看答案及解析
-
右图曲线a表示放热反应
X(g) + Y(g)
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
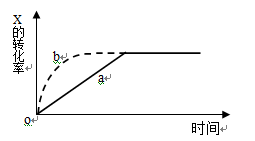
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B. 25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
难度: 中等查看答案及解析
-
下列说法正确的是( )
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol·L-1与0.1 mol·L-1醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
④纯水在100 ℃和20 ℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
A.①④⑤ B.①⑤⑥ C.①②⑤ D.①②③⑥
难度: 中等查看答案及解析
-
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
难度: 中等查看答案及解析
-
已知热化学反应方程式:
Zn(s)+1/2O2(g)
ZnO(s);ΔH=-351.5 kJ·mol-1
Hg(l)+ 1/2O2(g)
HgO(s);ΔH=-90.84 kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
ZnO(s)+Hg(l)的ΔH为
A. ΔH=+260.7 kJ·mol-1 B. ΔH=-260.7 kJ·mol-1
C. ΔH=-444.2 kJ·mol-1 D. ΔH=+444.2 kJ·mol-1
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是
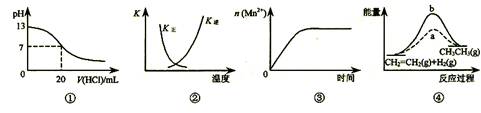
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)
2SO3(g) ΔH < 0 ,正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(已知Mn2+是KMnO4 酸性溶液与H2C2O4反应的催化剂 )
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g) ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
难度: 中等查看答案及解析
-
下列关于可逆反应:2SO2 + O2
2SO3的说法正确的是
A.1mol SO2与足量O2反应,可以生成1mol SO3
B.平衡时,c(SO2)∶c(O2) ∶c(SO3)=2∶1∶2
C.当O2的质量不再变化时,反应达到平衡
D.当反应达到平衡状态时,v(O2)=0
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I (s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为

难度: 中等查看答案及解析