-
下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸反应 B.灼热的木炭与CO2反应
C.乙醇在氧气中燃烧 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度: 中等查看答案及解析
-
下面有关13C、15N的叙述正确的是
A.15N与14N互为同位素 B.13C与C60互为同位素
C.13C与15N有相同的中子数 D.15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
下列粒子中,与NH4+具有相同质子数和电子数的是
A.OH— B.F- C.Na+ D.NH3
难度: 中等查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在离子键和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
难度: 中等查看答案及解析
-
下列关于化学用语的表述正确的是
A.HCl的电子式:
B.
离子的原子结构示意图:
C.CO2分子的结构式:O=C=O D.四氯化碳分子比例模型:
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是

难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D.PCl5
难度: 中等查看答案及解析
-
根据下表信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.R的气态氢化物的水溶液显酸性
难度: 中等查看答案及解析
-
下列过程只需要克服分子间作用力的是
A.碘单质升华 B.HCl气体溶于水 C.氯化镁受热熔化 D.二氧化硅受热熔化
难度: 中等查看答案及解析
-
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
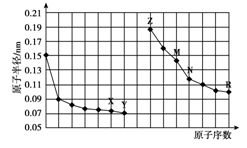
A.简单离子的半径:X <Z < M
B.Y、R两种元素的气态氢化物稳定性:Y>R
C.最高价氧化物对应水化物的酸性:R<N
D.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
难度: 中等查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是
A.元素原子最外层电子数越多,元素金属性越强
B.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
C.Si、P、S、Cl元素的单质与氢气化合越来越容易
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
难度: 中等查看答案及解析
-
下列说法正确的是
A.化学反应中的能量变化,都表现为热量的变化
B.需要加热才能发生的反应,一定是吸收能量的反应
C.释放能量的反应在常温下一定很容易发生
D.是吸收能量的反应还是释放能量的反应,应看反应物的总能量和生成物的总能量的相对大小
难度: 简单查看答案及解析
-
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O=O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 中等查看答案及解析
-
下列关于能量转换的认识中,不正确的是
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
难度: 中等查看答案及解析
-
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种溶液中,能观察到有电流产生的是
A.用铜片、铅笔芯作电极插入蔗糖溶液中 B.用两个铜片作电极插入硝酸银溶液中
C.用锌片、铜片作电极插入番茄中 D.用铜片、铁片作电极插入酒精中
难度: 中等查看答案及解析
-
能够证明甲烷分子的空间结构为正四面体的事实是
A.甲烷的二氯代物只有1种 B.甲烷分子中4个C—H键的长度相同
C.甲烷的一氯代物只有1种 D.甲烷分子中4个C—H键的强度相同
难度: 中等查看答案及解析
-
如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是
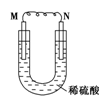
A.N上有气体放出 B.M为负极,N为正极
C.是化学能转变为电能的装置 D.导线中有电流通过,电流方向是由M到N
难度: 中等查看答案及解析
-
如图装置中,U形管内为红墨水,a、b试管内分别盛有(显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+腐蚀,放置一段时间。下列有关描述错误的是

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-===Fe2+
D.a试管中O2得电子,b试管中H+得电子
难度: 中等查看答案及解析
-
向四个体积相同的密闭容器中分别充入一定量的SO2和O2,甲:500 ℃,10 mol SO2和5 mol O2反应;乙:500 ℃,V2O5作催化剂,10 mol SO2和5 mol O2反应;丙:450 ℃,8 mol SO2和5 mol O2反应;丁:500 ℃,8 mol SO2和5 mol O2反应,开始反应时,按反应速率由大到小的排列顺序正确的是
A.甲、乙、丙、丁 B.乙、甲、丙、丁 C.乙、甲、丁、丙 D.丁、丙、乙、甲
难度: 中等查看答案及解析
-
在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 中等查看答案及解析
-
下列描述的化学反应状态,不一定是平衡状态的是
A.H2(g)+Br2(g)
2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)
N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)
CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变
D.3H2(g)+N2(g)
2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+3Y2(g)
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度
有可能是
A.c(Z)=0.5 mol·L-1 B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1 D.c(Y2)=0.6 mol·L-1
难度: 中等查看答案及解析
-
下列物质之间的相互关系错误的是
A.CH3CH2CH2CH2CH3和
互为同分异构体 B.干冰和冰为同一种物质
C.CH3CH3和CH3CH2CH3互为同系物 D.12C和14C互为同位素
难度: 简单查看答案及解析