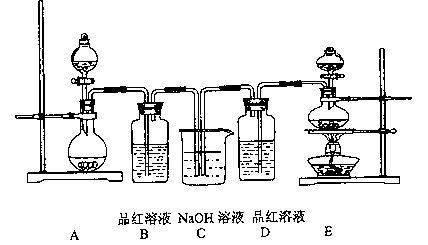
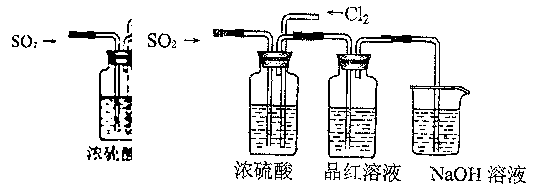
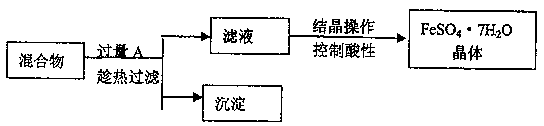
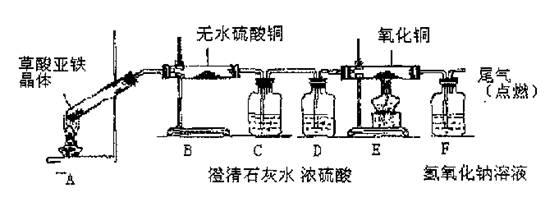
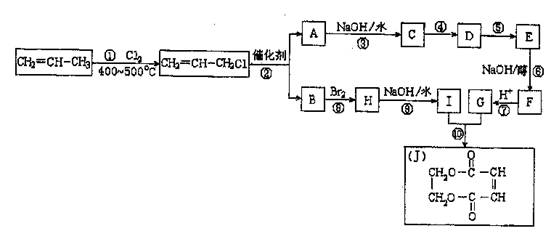
-
下列做法不能体现低碳生活的是 ( )
A.尽量购买本地的、当季的食物
B.用石油液化气代替天然气
C.瑞士馆用大豆纤维制成的红色幕帷,能发电,可天然降解
D.零排放的燃料电池汽车
难度: 中等查看答案及解析
-
下列有关物质结构的表述正确的是 ( )
A.氧化铝的分子式Al2O3
B.CO2的电子式:

C.硫原子的最外层电子轨道表示式3s23p4
D.Cl-的结构示意图
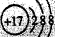
难度: 中等查看答案及解析
-
有机物
 的正确命名为 ( )
的正确命名为 ( )A.2—乙基-3,3—二甲基—4—乙基戊烷
B.3,3—二甲基—4—乙基已皖
C.3,3,4--甲基已烷
D.2,3,3-三甲基已烷
难度: 中等查看答案及解析
-
下列物质不能通过化合反应直接制得的是 ( )
A.FeCl2 B.NaHSO3 C.Cu(OH)2 D.Fe (OH)3
难度: 中等查看答案及解析
-
下列判断正确的是 ( )
A.元素周期表中查得的相对原子质量为同使素的相对原子质量
B.化学键的变化一定会引起化学反应的变化
C.酸性氧化物一定是非金属氧化物
D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
难度: 中等查看答案及解析
-
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是 ( )
A.氯气 B.二氧化碳 C.醋酸钠 D.碘化钾
难度: 中等查看答案及解析
-
下列各组物质性质比较中正确的是: ( )
A.常温常压下溶解度: CaCO3<Na2CO3<NaHCO3
B.氧化性:Mg2+<H+<Cu2+<Fe3+
C.酸性:H4SiO4<H3PO4<H2SO4<HClO
D.沸点:SiC>I2>Si>HF
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.46g的NO2和N2O4所含原子数均为3NA
B.25℃时,pH=13的l.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.molNa2O2固体中含离子总数为4NA
D.标准状况下,2. 24LSO3所含分子数为0.1NA
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.能与酸反应的氧化物,一定是碱性氧化物
B.CC3N4晶体中,C—N键的键长比金刚石中的C-C键的键长要长
C.分子晶体中分子间作用力越大,其分子越稳定
D.分子晶体溶于水时,有些分子中的化学键被破坏,有些分子中的化学键不被破坏
难度: 中等查看答案及解析
-
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )
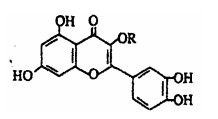
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
难度: 中等查看答案及解析
-
下列实验设计和结论相符的是 ( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO2-4
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
难度: 中等查看答案及解析
-
下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.澄清透明的无色溶液中:Cl-、MnO-4、Ag+、SO2-4
B.在能使pH试纸变红色的溶液中:Na+、NO-3、S2-、CO2-3
C.在加入铝粉能产生H2的溶液中:NH+4、K+、SO2-4、NO-3
D.在由水电离出的c(OH-)=10-13mol/L-1的溶液中:Na+、Ba2+、Cl-、I
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( )
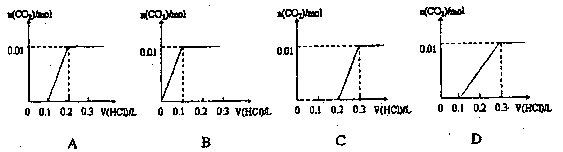
难度: 中等查看答案及解析
-
pH=4的FeCl3溶液和pH=10的Na2CO3溶液中,水的电离度分别为
,则它们的大小关系是 ( )
A.
B.
C.
D.无法判断
难度: 中等查看答案及解析
-
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)2 D.FeS、Al(OH)3和S
难度: 中等查看答案及解析
-
根据热化学方程式:S(s)+ O2(g)→SO2(g)+297.23 kJ,下列说法正确的是( )
A.1 mol SO2(g)的能量总和大于l mol S(s)和1 mol O2(g)的能量总和
B.1个硫分子与1个氧气分子反应生成2个二氧化硫气体分子放出297.23 kJ热量
C.S(g)+O2(g)→SO2(g)+QkJ; Q1的值大于297.23
D.S(g)+O2(g)→SO2(g)+QkJ;Q1的值小于297.23
难度: 中等查看答案及解析
-
amol FeS与bmol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④
mol
A.①④ B.②③ C.①③ D.②④
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CC14是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子处在2个O原予所连成的直线的中央
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是 ( )
A.弱酸尼泊金酸(
)与足量的碳酸氢钠溶液反应
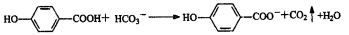
B.将0.0lmol氯气遥入10mL 1mol/L的FeB12消液中
2Fe2++2Br一+3C12→2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液
Ca2++HCO-3+OH-→CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入KHSO4溶液至Ba2+刚好沉淀完全
Ba2++OH-+H++ SO2-4→BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是 ( )
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)=c(H+)·c(OH-)
B.1L0.1mol·L-lCuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO2-4)>c(NH+4)>c(Cu2+)>c(H+)>c(OH-)
C.0.l mol.L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO-3)+c(CO2-3)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
难度: 中等查看答案及解析
-
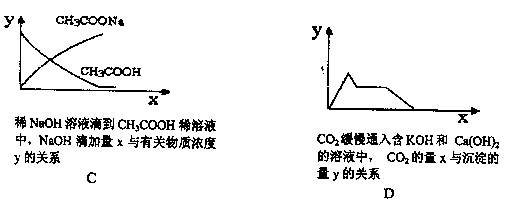
下列坐标图所表示的量的关系正确的是 ( )

难度: 中等查看答案及解析
-
12在KI溶液中存在下列平衡:
I2(aq)+I-(aq) I-3(aq)
某I2、、KI混合溶液中,I-3的物质的量浓度c(i-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
A.反应I2(aq)+I-(aq) I-3(aq)的Q<0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
难度: 中等查看答案及解析