-
化学与生产生活密切相关,下列说法不正确的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,其作用原理相同
C.合金材料钢铁在潮湿的空气中易发生电化学腐蚀
D.玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要石灰石难度: 中等查看答案及解析
-
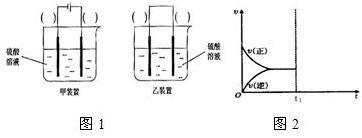
下列叙述正确的是( )
A.非金属元素的原子间只能形成共价键
B.Po和
Po互为同位素,电子数相差10
C.加入铝粉能够产生氢气的溶液中,可能含有Na+、NO3-、Cl-、S2-四种离子
D.除去NaCl固体中混有的MgCl2杂质:加入足量KOH试剂后过滤,然后将滤液加热蒸干难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越易失去电子
B.镧系元素和锕系元素均属位于第Ⅷ族
C.原子最外层电子数为2或8的元素为稀有气体元素
D.离子化合物一定含有离子键,其组成元素一定为典型的金属元素和非金属元素难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.易溶于酒精、汽油、苯等有机溶剂的物质一定是有机化合物
B.淀粉、纤维素水解的最终产物都是葡萄糖
C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D.钠跟水反应比跟乙醇反应剧烈难度: 中等查看答案及解析
-
下列有关化学用语的表述正确的是(NA表示阿伏伽德罗常数)( )
A.碳酸氢铵与足量的氢氧化钠两溶液混合:HCO3-+OH-=CO32-+H2O
B.废气中的SO2在飘尘做催化剂的作用下会部分转化为SO3,使空气的酸度增加,环境污染更为严重
C.常温常压下,2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为一定为0.1NA
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COO-)难度: 中等查看答案及解析
-
T℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)⇌cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )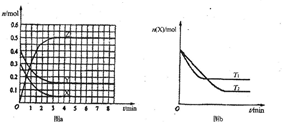
A.该反应的正反应是放热反应,且T1>T2
B.X、Y、Z的化学反应速率之比为1:1:2
C.图a中反应达到平衡时,Y的转化率为37.5%
D.若T1>T0,则该反应的化学平衡常数K(T1)<K(T0)难度: 中等查看答案及解析
-
室温下,0.1mol•L-1某一元碱酸(AOH)溶液中
,下列叙述不正确的是( )
A.该一元碱溶液的pH=11
B.该溶液中由水电离出的c(OH-)=1.0×10-11mol•L-1
C.该溶液中水的离子积常数Kw为1.0×10-14mol2•L-2
D.用pH=1的盐酸溶液V1L与V2L0.1mol•L-1的AOH溶液混合,若混合溶液pH=7,则V1<V2难度: 中等查看答案及解析