-
著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是( )
A.电子
B.中子
C.质子
D.原子核难度: 中等查看答案及解析
-
与Na+具有相同质子数和电子数的微粒是( )
A.F-
B.NH4+
C.OH-
D.H2O难度: 中等查看答案及解析
-
下列观点中正确的是( )
A.通过化学变化一定能改变物质的性质
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子里的电子数不会改变
D.任何变化中原子核都不会发生改变难度: 中等查看答案及解析
-
人体是一座元素的“仓库”,地壳中天然存在的化学元素,大多数能在人体中找到,其中含量最高的元素是( )
A.氢
B.碳
C.氧
D.钙难度: 中等查看答案及解析
-
已知R元素的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等.若R2+核外有x个电子,则其原子核内的中子数为( )
A.m-x+2
B.m+x-2
C.m-x-2
D.m+x-2难度: 中等查看答案及解析
-
科学家最近在-100℃的低温下合成一种化合物X,此分子的模型如下图,其中每个
代表一个碳原子,每个○代表一个氢原子.下列说法中不正确的是( )
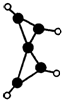
A.该分子的分子式为C5H4
B.该分子中碳元素的质量分数是93.75%
C.该分子中的氢原子与碳原子的个数比是4:5
D.等质量的该物质与甲烷相比,燃烧时消耗的氧气更多难度: 中等查看答案及解析
-
在反应X+2Y=R+2M中,已知R和M的相对分子质量之比为1:2,当1.5gX和一定量的Y 充分反应后,生成了3.6gM.则在上述反应中,参加反应的X和Y的质量比为( )
A.1:2
B.2:1
C.1:4
D.4:1难度: 中等查看答案及解析
-
某学生用托盘天平称量5.5gNaCl晶体(1g以下用游码),称量时误将药品与砝码的位置颠倒.该学生所称NaCl的实际质量是( )
A.6g
B.5.5g
C.5.0g
D.4.5g难度: 中等查看答案及解析
-
某学生测得海水中含Cl-的质量分数为2.19%,如果全部以NaCl计算,则海水中所含NaCl的质量分数是( )
A.2.82%
B.5.85%
C.3.60%
D.4.91%难度: 中等查看答案及解析
-
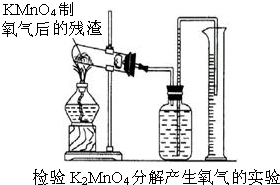
如图所示装置,有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放适量蒸馏水.以下说法不正确的是( )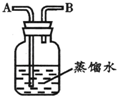
A.导管B连接供给氧气的钢瓶
B.导管B连接病人吸氧气的塑胶管
C.该装置可用来观察输出氧气的速度
D.该装置可用来调节输出氧气的速度难度: 中等查看答案及解析
-
不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定是目前世界上最小的温度计.研究人员在长约10-6m,直径为10-7m的碳纳米管中充入液态的金属镓.当温度升高时,管中镓就会膨胀,通过电子显微镜就能读取温度值.这种温度计测量的范围可从30℃到490℃,并且精确度较高,可用于检查电子线路是否异常、测量毛细血管的温度等许多方面.根据以上信息判断下列推测中正确的是( )
A.碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计
B.金属镓的熔点、沸点都很低
C.在30℃到490℃之间金属镓的体积与温度变化呈正比
D.金属镓的体积在30℃到490℃之间随温度变化很小,可忽略不计难度: 中等查看答案及解析
-
中国科学家以二氧化碳和金属钠为原料,在一定条件下制得了金刚石,化学方程式为:3CO2+4Na
xR+C(金刚石),则x;R为( )
A.1;Na2CO3
B.2;Na2CO3
C.3;Na2CO3
D.4;Na2O2难度: 中等查看答案及解析