-
化学与生产、生活等方面密切相关,下列选项中不正确的是
A. 普通玻璃和氮化硅陶瓷分别属于传统无机非金属材料和新型无机非金属材料
B. 硝酸铵可用作化肥,也可以用作炸药
C. 只用蒸馏水就可以鉴别纯碱和食盐
D. 游泳池用臭氧或者活性炭消毒的原理相同
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 78gNa2O2与足量SO2 充分反应转移电子数为NA
B. 100gCaS与CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
C. 1molNa2CO3 和NaHCO3的混合物中CO32-的数目为NA
D. 3mol单质Fe在氧气中完全燃烧转变为Fe3O4,得到8NA个电子,
难度: 困难查看答案及解析
-
化学中有很多有趣的分子,比如图中所示分子被化学家命名为“小狗烯”,下列关于“小狗烯”的说法错误的是
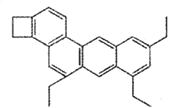
A. “小狗烯”的分子式是C26H26 B. “小狗烯”中含有四个苯环
C. “小狗烯”中所有碳原子一定共面 D. “小狗烯”可以发生加成反应、氧化反应和取代反应
难度: 中等查看答案及解析
-
下列实验操作对应的现象和根据现象得出的结论均正确的是
实验操作
现象
结论
A
向FeCl3溶液中滴加稀氨水
溶液由黄色变为红棕色
生成了氢氧化铁胶体
B
碳和浓硫酸加热所得气体产物依次通过品红溶液和澄淸石灰水
品红溶液褪色,澄清石灰水变浑浊
气体产物中含有CO2和SO2
C
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
裂化汽油与碘水混合振荡并静置分层
有机层显紫色,水层变为无色
裂化汽油将碘萃取到有机层中
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
a、b、c、d、e是原子序数依次增大的五种元素,其中a的最高正价与最低负价的绝对值相等,b 的某种单质是自然界中硬度最大的物质,c 的氢氧化物为两性物质,d、e 可组成M、N 两种化合物,其中M 和铜的反应常用于刻制印刷电路板。下列说法正确的是
A. a与b 可形成多种既含极性键又含非极性键的物质
B. b的单质均不能导电
C. 可用电解熔融氯化物的方法冶炼e的单质
D. N物质不能通过化合反应得到
难度: 困难查看答案及解析
-
下图中的电化学装置以甲醇(CH3OH)为主要原料合成碳酸二甲酯[(CH3O)2CO],相关说法错误的是

A. B是直流电源的负极
B. 碳酸二甲酯中碳均为+4价
C. 阳极附近溶液pH降低
D. 每当有2molH+通过离子交换膜,消耗氧气的体积在标准状况下为11.2L
难度: 困难查看答案及解析
-
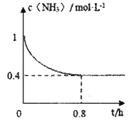
常温下CH3COOH 的电离常数为1.7×10-5,该温度下用0.1mol·L-1的醋酸溶液滴定10.00mL等物质的量浓度的碱ROH,滴定过程中加入醋酸的体积(V)与溶液中
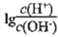 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是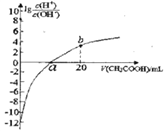
A. b点溶液显碱性
B. a>10.00
C. ROH 的电离方程式为ROH
R++OH-
D. 25℃时,1mol·L-1的醋酸溶液中CH3COO-的浓度约为4.12×10-2mol·L-1(已知
=4.12)
难度: 困难查看答案及解析