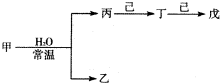
-
对物质进行分类是一种简单、有效的科学方法.下列各组物质的分类都正确的是( )
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、NaOH(强电解质)难度: 中等查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下列判断不正确的是( )
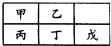
A.原子半径:丙>丁>戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:乙=丁>甲=丙难度: 中等查看答案及解析
-
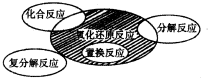
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )
A.2Na2O2+2CO2=2Na2CO3+O2
B.2NaHCO3═Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.Cl2+2KBr═Br2+2KC1难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol.L-1 NaOH溶液:K+、Na+、SO2-4、CO2-3
B.0.1 mol•L-1 Na2CO3溶液:K+、Ba2+、NO-3、Cl-
C.0.1 mol•L-1 FeCl3溶液:K+、NH+4、I-、SCN-
D.=1×l014的溶液:Ca2+、Na+、ClO-、NO-3
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.100 g 63%的浓硝酸中含氧原子个数为3NA
B.5.6 g铁在硫蒸气中完全反应,转移的电子数为0.3 NA
C.标准状况下,CO和C2H4的混合气体22.4 L,其质量为28 g
D.58.5 g NaCl晶体中含有的NaCl分子数为NA难度: 中等查看答案及解析
-
在氧化还原反应中,氧化剂可能全部被还原,也可能部分被还原,下列反应中,
①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
②C+4HNO3(浓)CO2↑+4NO2↑+2H2O
③Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O
④4Zn+10HNO3(稀)4Zn(NO3)2+N2O↑+5H2O
氧化剂被还原的比例从高到低的顺序正确的是( )
A.②①③④
B.②④①③
C.④③①②
D.③②①④难度: 中等查看答案及解析
-
某烧杯中盛有0.2mol NH4Al(SO4)2的溶液,向其中缓缓加入4mol•L-1的NaOH溶液200mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A.Al3+和Al(OH)3
B.AlO-2
C.AlO-2和Al(OH)3
D.Al(OH)3难度: 中等查看答案及解析
-
在体积恒定的密闭容器中,1mol A(g)与1mol B(g)在催化剂作用下加热到500℃发生反应:A(g)+nB(g)
C(g)+D(g);△H>0达到平衡,下列判断正确的是( )
A.升高温度v正增大,v逆减小,平衡向正反应方向移动
B.平衡后再加入l mol B,上述反应的△H增大
C.当n<1时,通人惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1难度: 中等查看答案及解析
-
下列与有机物相关的叙述正确的是( )
①CH4O与C2H6O一定互为同系物
②1mol C6H6(苯)中含有3mol碳碳双键
③有机物CH2=CH-CH(OH)COOH中含有三种官能团
④糖类有可能是天然高分子化合物,油脂一定不是天然高分子化合物.
A.①②
B.③④
C.①③
D.②④难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO-3+3H2O═3I2+6OH-
B.硅酸钠溶液与醋酸溶液混合:+2H+═H2SiO3↓
C.向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时:2Al3++3+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
D.浓硝酸中加入过量铁粉并加热:Fe+3+6H+
Fe3++3NO2↑+3H2O
难度: 中等查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 物质转化关系 a b c d ① 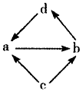
FeCl2 FeCl3 Fe CuCl2 ② NO NO2 N2 HNO3 ③ Na2O Na2O2 Na NaOH ④ Al2O3 NaAlO2 Al Al(OH)3
A.①④
B.②③
C.①③
D.②④难度: 中等查看答案及解析
-
由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )
A.混合气体中C16O和C18O的分子数之比为14:15
B.混合气体中C16O和C18O的物质的量之比为1:1
C.混合气体中C16O和C18O的质量之比为15:14
D.混合气体中C16O和C18O的密度之比为1:1难度: 中等查看答案及解析
-
分子式为C10H14的三取代芳烃(即苯环上只有三个支链),其可能的结构有( )
A.5种
B.6种
C.7种
D.8种难度: 中等查看答案及解析
-
在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是( )
A.甲(Na)>乙(Mg)>丙( Al)
B.甲(Na)>乙(Mg)=丙( Al)
C.甲(Na)<乙(Mg)<丙( Al)
D.甲(Na)=乙( Mg)=丙(Al)难度: 中等查看答案及解析