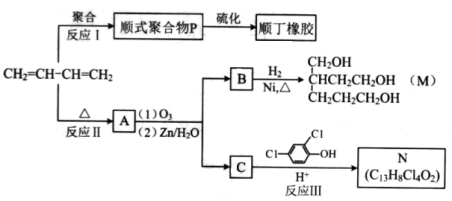
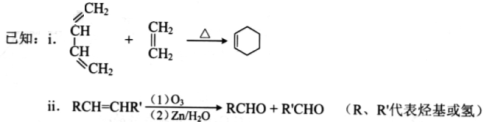
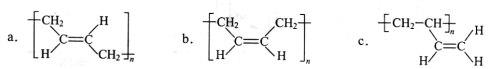
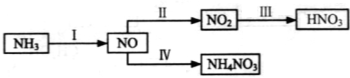
-
下列试剂中,标签上应标注
 和
和 的是( )
的是( )A.C2H5OH B.HNO3 C.NaOH D.HCl
难度: 简单查看答案及解析
-
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )
A.K B.Na C.Fe D.Al
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.油脂在酸性或碱性条件下均能发生水解反应,且产物相同
难度: 简单查看答案及解析
-
用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
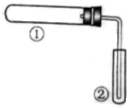
①中实验
②中现象
A
铁粉与水蒸气加热
肥皂水冒泡
B
加热NH4Cl和Ca(OH)2混合物
酚酞溶液变红
C
NaHCO3固体受热分解
澄清石灰水变浑浊
D
石蜡油在碎瓷片上受热分解
Br2的CCl4溶液褪色
难度: 简单查看答案及解析
-
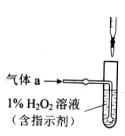
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析