-
实验室常用NaNO2和NH4Cl反应制取N2.下列说法正确的是( )
A.NaNO2是还原剂
B.NH4Cl中N元素被还原
C.生成1 mol N2时转移6 mol 电子
D.氧化剂和还原剂的物质的量之比是1:1难度: 中等查看答案及解析
-
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A.盐酸、水煤气、醋酸、干冰
B.液氯、氯水、硫酸钠、乙醇
C.空气、天然气、苛性钾、石灰石
D.胆矾、漂白粉、氯化钾、氯气难度: 中等查看答案及解析
-
根据相关的化学原理,下列判断正确的是( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C.若A2+2D-═2A-+D2,则氧化性D2>A2
D.若R2-和M+的电子层结构相同,则离子半径R2->M+难度: 中等查看答案及解析
-
最新科技报道,美国夏威夷联合天文中心科学家发现新型氢粒子,这种新粒子是由3个氢原子核(只有质子)和2个电子构成,对于这种粒子,下列说法中正确的是( )
A.是氢的一种新的同素异形体
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比一个普通H2分子多一个氢原子核难度: 中等查看答案及解析
-
氯化钠是一种重要的生活、生产必需品.下列表述中正确的是( )
A.NaCl的电子式为
B.23Na37Cl中质子数和中子数之比是8:7
C.电解熔融氯化钠可得到氯气和金属钠
D.欲配制1.00 L 1.00 mol/L的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关,下列说法正确的是( )
A.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
B.从海水中可提取Na,用惰性电极电解熔融的NaCl或其水溶液都可制得Na
C.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D.煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法难度: 中等查看答案及解析
-
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A.硫的原子结构示意图: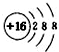
B.NH4Br的电子式: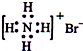
C.中子数为20的氩原子:2018Ar
D.Be2+ 中的质子数和电子数之比为2:1难度: 中等查看答案及解析
-
下列过程中属于物理变化的是( )
①白色的硫酸铜粉末久置于空气中变成蓝色
②同素异形体之间的相互转化
③胶体的电泳
④十水合碳酸钠的风化
⑤氯化钠溶液通电后导电
⑥给装有氯化铵的试管加热,管口又有白色晶体产生
⑦某些金属的焰色反应.
A.只有②③⑥
B.只有①③⑦
C.只有③⑦
D.只有③⑤⑦难度: 中等查看答案及解析
-
进行化学实验观测实验现象,通过分析推理得出正确的结论,这是化学学习的方法之一.下列对有关实验事实的解释中,正确的是( )
A.将SO2气体通过酸性高锰酸钾溶液,溶液褪色.体现了SO2的漂白性
B.铜浓硝酸反应生成NO2而稀硝酸生成NO.说明稀硝酸比浓硝酸氧化性强
C.将纯净的金属钠放在空气中,颜色由银白色很快变暗.说明钠的化学性质活泼
D.常温下,将铝片放入浓硫酸中,无明显现象.说明铝与冷的浓硫酸不反应难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况.下列反应中属于这种情况的是( )
A.过量的MnO2与浓盐酸反应
B.过量的Zn与18 mol/L的硫酸反应
C.过量的Br2与FeI2反应
D.过量的O2与NH3在催化剂存在下反应难度: 中等查看答案及解析
-
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
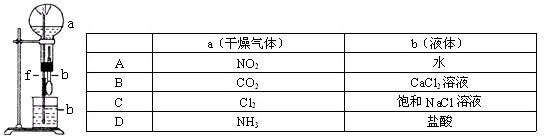
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.制普通玻璃的主要原料是烧碱、石灰石、石英
B.常用氢氟酸(HF)来刻蚀玻璃
C.实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
D.光导纤维的主要成份是硅难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
① ② ③ ④ A 黄绿色 橙色 蓝色 红色 B 无色 橙色 紫色 白色 C 黄绿色 橙色 蓝色 白色 D 黄绿色 无色 紫色 白色 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.加入Al能放出H2的溶液中:NH4+,Cl-,K+,SO42-,NO3-
B.水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,NO3-,NH4+,SO32-
C.pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
D.使石蕊变红的溶液中:Fe2+,MnO4-,NO3-,Na+,SO42-难度: 中等查看答案及解析
-
Zn(OH)2是两性氢氧化物,和强酸反应时生成Zn2+,跟强碱反应时生成ZnO22-.现有三份等物质的量浓度、等体积的MgCl2、ZnCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液,分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如下图所示,则与MgCl2、ZnCl2、AlCl3三种溶液一一对应的正确图象是( )
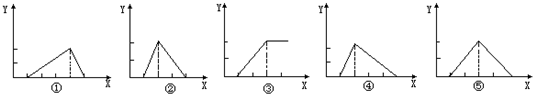
A.③②④
B.③⑤①
C.③⑤④
D.③②①难度: 中等查看答案及解析
-
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是( )
A.和水反应
B.和硫酸反应
C.和氢氧化钠反应
D.和氯气反应难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
①1L1mol•L-1FeCl3完全水解生成NA个胶体粒子
②标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/NAg
③1.20g NaHSO4晶体中阳离子和阴离子的总数为0.02NA
④3NA个NO2分子跟水分子充分作用,转移的电子数为2NA
⑤1molCl2与足量的铁粉完全反应,转移的电子数为3NA
⑥含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子
⑦一定条件下,1molN2与足量H2反应,可生成2NA个NH3分子.
A.②③④
B.①③④⑥
C.②③⑤⑦
D.④⑤⑥⑦难度: 中等查看答案及解析
-
下列实验不能达到预期目的是( )
①用硝酸钡溶液鉴别CO2和SO2 ②用如图装置吸收残余氨气
③用乙醇从碘水中萃取碘 ④用pH试纸测氯水的pH
⑤用加热方法提纯含碳酸氢钠的碳酸钠固体
⑥用铝和足量NaOH溶液充分反应,蒸干溶液制纯净NaAlO2
⑦用相互滴加的方法鉴别NaAlO2和NaHSO4溶液.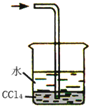
A.只有①③⑥
B.只有③④⑥
C.只有①②④⑤
D.只有②③④⑤⑥难度: 中等查看答案及解析
-
向10mL 0.1mol•L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)难度: 中等查看答案及解析
-
2.8gFe全部溶于一定浓度200mLHNO3溶液中,得到标准状况下气体1.12L,测得反应后溶液pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是( )
A.反应后溶液中铁元素一定只以Fe3+形式存在
B.1.12L气体可能是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol/L
D.反应后的溶液最多还能溶解1.82gFe难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )

A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4难度: 中等查看答案及解析
