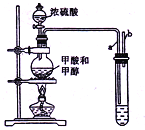
-
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为Zn+4OH—2e- =Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 放热反应在常温下一定很容易发生
C. 判断反应是放热还是吸热必须看反应物和生成物具有的总能量的相对大小
D. 已知石墨(s)比金刚石(s)稳定,则石墨(s)转化为金刚石(s)要放出能量
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 食用白糖的主要成分是蔗糖 B. 淀粉、纤维素和油脂都是属于天然高分子化合物
C. 植物油的主要成分是高级脂肪酸 D. 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖
难度: 简单查看答案及解析
-
下列各组中的反应,属于同一反应类型的是( )
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环已烷制环已烯;由丙烯制1,2二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 中等查看答案及解析
-
下列八种物质中,既能使酸性高锰酸钾溶液褪色又能因反应使溴的四氯化碳溶液褪色的是( )
①甲烷 ②苯 ③聚乙烯 ④聚异戊二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧环己烯
A. ②③④⑤⑥ B. ①④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
难度: 简单查看答案及解析
-
分子式为C7H14O2的有机物Q在稀硫酸溶液中加热可转化为乙醇与另一种酸性物质,则Q的结构最多有( )
A. 6种 B. 4种 C. 3种 D. 2种
难度: 中等查看答案及解析
-
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1 ②N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-534kJ·mol-1下列关于肼和NO2反应的热化学方程式中,正确的是( )
A. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) △H= -1135.7kJ·mol-1
B. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1000.3kJ·mol-1
C. N2H4(g)+NO2(g)=
N2(g)+2H2O(l) △H= -500.15kJ·mol-1
D. 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,可逆反应2NO2(g)
2NO(g)+O2(g)在容积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2,同时生成2n molNO2
②单位时间内生成n molO2,同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化的反应速率之比为2:2:1
④混合气体的压强不再改变 ⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
难度: 困难查看答案及解析
-
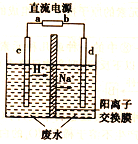
传感器可以检测空气中SO2的含量。传感器的工作原理如图所示,下列叙述正确的是( )
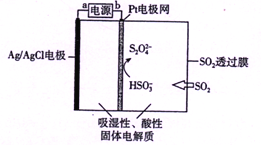
A. a为电源的负极
B. 负极的电极反应式:Ag-e-+Cl-= AgCl
C. 阴极的电极反应式:2HSO3-+2H++2e- = S2O42-+2H2O
D. 当电路中转移电子的物质的量为5×10-5mol时,进入传感器的SO2为1.12mL
难度: 困难查看答案及解析
-
常温下,下列有关电解质溶液的说法正确的是( )
A. pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH减小2
B. pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度
C. 0.2mol CO2通入1L0.3mol·L-1 KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-)
D. 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
难度: 困难查看答案及解析
-
250C时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4.下列关系式中正确的是( )
A. a2=a3<a4<a1 B. a3=a2<a1<a4 C. a2<a3<a1<a4 D. a1<a2<a3<a4
难度: 困难查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g) △H=Q(Q<0),向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2 和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙<2p乙
B. SO3的质量m:m甲=m丙<2m乙
C. c(SO2)与c(O2)之比k:k甲=k丙>2k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析
-
下列有机物的命名正确的是( )
A. 二溴乙烷:CH2BrCH2Br
B. 3-乙基-1-丁烯:
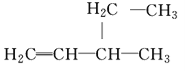
C. 2-甲基-2,4-己二烯:
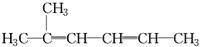
D. 2,2,3-三甲基戊烷:
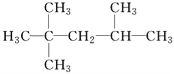
难度: 简单查看答案及解析
-
某高分子材料的结构简式如图所示:已知该高分子材料是由三种单体聚合而成的,下列与该高分子材料相关的说法正确的是( )
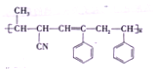
A. 该高分子材料是体型高分子,合成它的反应是加聚反应
B. 形成该高分子材料的单体
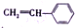 中,所有原子可能处于同一平面内
中,所有原子可能处于同一平面内C. 三种单体中有两种有机物互为同系物
D. 三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
茶是我国的传统饮品,茶叶中含有茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
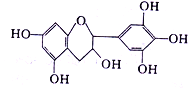
①分子式为C15H14O7 ②1mol儿茶素A在一定条件下最多能与7mol H2加成 ③等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应消耗金属钠和氢氧化钠的物质的量之比为1:1 ④1mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4mol
A. ①② B. ②③ C. ③④ D. ①④
难度: 困难查看答案及解析
-
2015年10月5日,屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构简式如图)获得诺贝尔生理学或医学奖。一定条件下青蒿素可以转化为双氢青蒿素。下列有关说法中正确的是( )
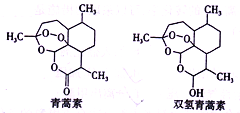
A. 青蒿素的分子式为C15H20O5
B. 1 mol青蒿素最多能和1 mol Br2发生加成反应
C. 双氢青蒿素能发生氧化反应、酯化反应
D. 青蒿素转化为双氢青蒿素发生了氧化反应
难度: 中等查看答案及解析
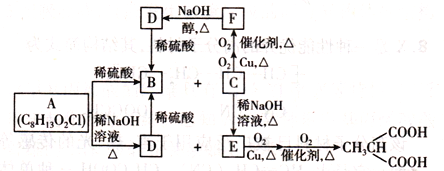
 、
、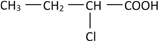 _____、______。
_____、______。