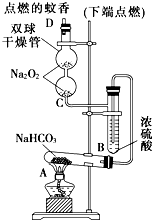
-
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期.Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+.下列推断正确的是( )
A.Tl+的最外层有1个电子
B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1价的化合物
D.Tl+的还原性比Ag强难度: 中等查看答案及解析
-
相同质量的钠在下列情况中产生氢气最多的是( )
A.放在足量水中
B.放在足量盐酸中
C.放在足量CuSO4溶液中
D.用刺有小孔的铝包好放入足量水中难度: 中等查看答案及解析
-
在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是( )
A.m1一定大于m2
B.m1可能小于m2
C.m1可能等于m2
D.m1一定等于m2难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.鉴别NaHCO3和Na2CO3溶液可以用饱和石灰水
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出难度: 中等查看答案及解析
-
下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HI>HBr>HCl>HF
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->I-难度: 中等查看答案及解析
-
相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是( )
A.36:69:92
B.23:12:9
C.1:2:3
D.9:12:23难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O难度: 中等查看答案及解析
-
将Cu片放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为( )
A.3:2
B.3:5
C.3:4
D.4:3难度: 中等查看答案及解析
-
有Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则下列分析中不正确的是( )
A.粒子半径大小的关系是Xn->Yn+、X<Y
B.Z是稀有气体原子
C.原子核电荷数:Z>Y>X
D.Xn-、Yn+、Z的核外电子数相同难度: 中等查看答案及解析
-
有NaCl、FeCl2、FeCl3、MgCl2、CuCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可以把它们鉴别开来,该试剂是( )
A.H2SO4
B.NaOH溶液
C.氨水
D.KSCN溶液难度: 中等查看答案及解析
-
下列电子式中,正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
X、Y、Z三种元素的原子具有相同电子层数,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.非金属性:X>Y>Z
B.含氧酸的酸性:H3ZO4>H2YO4>HXO4
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的最低负化合价的绝对值按X、Y、Z顺序由大到小难度: 中等查看答案及解析
-
氢化铵(NH4H)与氯化铵结构相似.已知NH4H与水反应有氢气产生,则下列叙述不正确的是( )
A.NH4H的电子式是:
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大
D.NH4H溶于水后,形成的溶液呈酸性难度: 中等查看答案及解析
-
已知甲、乙、丙、丁四种短周期元素在周期表中的位置如图所示,则下列说法中不正确的是( )
A.甲和乙电子层数相同
B.乙和丁最外层电子数相同
C.原子序数:丁>丙>甲>乙
D.最外层电子数:丁>丙难度: 中等查看答案及解析
-
已知氢有3种核素:
,氯有2种核素:
,则HCl分子的相对分子质量数值可能有几种( )
A.1种
B.5种
C.6种
D.1000种难度: 中等查看答案及解析
-
在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Al3+、Cl-
B.Na+、CO32-、K+、NO3-
C.Cu2+、K+、SO42-、Cl-
D.Ba2+、K+、Cl-、CO32-难度: 中等查看答案及解析
-
据新华社电2009年12月5日零时20分,一辆装载黑火药的江西籍大货车行驶至京珠高速湖北段时起火爆炸,造成现场4人死亡,高速路面严重损毁.黑火药爆炸过程中发生反应的化学方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑.下列说法正确的是( )
A.每生成55 g K2S转移电子数为6.02×1023
B.S和KNO3均为还原剂
C.反应过程中氮元素被还原
D.CO2为还原产物难度: 中等查看答案及解析
-
将盛有12毫升NO的试管倒置在水中,缓缓通入一定量氧气后,如果试管内气体体积变为4毫升,则通入氧气的体积可能是( )
A.7毫升
B.8毫升
C.11毫
D.13毫升难度: 中等查看答案及解析
-
一定条件下,将6体积的NO2和一定体积的NO与4.5体积的氧气组成的混和气体置于试管中.将试管倒置于水中,充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积;②4体积;③5体积;④5.5体积;⑤2体积.
A.③
B.⑤
C.④或⑤
D.②或⑤难度: 中等查看答案及解析
-
25.6mg铜跟含有1.4×10-3mol HNO3的浓硝酸恰好完全反应,反应完毕后收集到的气体在标况下的体积为( )
A.7.84 mL
B.13.44 mL
C.15.68 mL
D.17.92 mL难度: 中等查看答案及解析
-
已知2.5克KClO3粉未和5.2克研细的碘在一定条件下按下式定量反应:a KClO3+bI2+cHCl=eIClx+fKCl+gH2O,其中x的取值为( )
A.1
B.3
C.5
D.7难度: 中等查看答案及解析
-
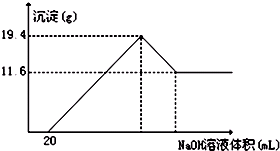
有无色溶液,加入Na2O2时有无色无味气体放出,并有白色沉淀生成,加入Na2O2的量与生成白色沉淀的量如图所示.该无色溶液中含有的物质是( )

A.CaCl2和MgCl2、
B.Al2 (SO4)3
C.Al2(SO4)3和MgSO4
D.Na2SO4和MgSO4难度: 中等查看答案及解析
-
碘是一种与人的生命活动密切相关的元素.已知碘单质能溶于NaOH或KI溶液,反应方程式分别为:I2+6OH-=5I-+IO3-+3H2O(HIO不稳定,易发生歧化反应)和I2+I-=I3-.溴化碘(IBr)是一种卤素互化物,具有与卤素单质类似的性质,下列反应方程式正确的有( )
A.IBr加入Na2S溶液中产生淡黄色浑浊:2IBr+S2-=2 I-+2Br-+S↓
B.少量IBr加入KI溶液中:IBr+I-=Br-+I2
C.IBr加入NaOH溶液中:IBr+2OH-=I-+BrO-+H2O
D.IBr加入AgNO3溶液中:3IBr+5Ag++3H2O=3AgBr↓+2AgI↓+IO3-+6H+难度: 中等查看答案及解析
-
已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )
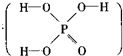
A.
B.
C.
D.难度: 中等查看答案及解析
-
甲试管中盛有0.5mol/L Na2CO3溶液10mL,慢慢往试管中加入1mol/L的盐酸7.0mL;乙试管中盛有1mol/L的盐酸7.0mL,慢慢往试管中滴加0.5mol/L Na2CO3溶液10mL,那么甲、乙两试管中产生的CO2物质的量大小关系为( )
A.甲=乙
B.甲>乙
C.甲<乙
D.无法确定难度: 中等查看答案及解析