-
下列反应的离子方程式书写不正确的是( )
A.氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.在氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
C.用SO2还原含Cr2O72-的酸性废水:Cr2O72- + 3SO2 + 2H+ = 2Cr3+ + 3SO42-+ H2O
D.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素外)。下列说法正确的是( )
A.工业上,Y元素氧化物对应水化物的浓溶液常用铝制或铁制容器盛装
B.X、Y、Z元素的气态氢化物中,Y的沸点最高
C.Z和X组成的化合物可作为缺氧场所的供氧剂
D.四种元素简单离子的半径由大到小依次为Y>Z>X>M
难度: 简单查看答案及解析
-
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g) + I2(g)
2HI(g);
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )

A.t0 时减小体积或升高体系温度
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.容器内气体颜色变深,平均相对分子质量不变
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c (OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+ 的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.③⑤ B.②④ C.①② D.③⑥
难度: 简单查看答案及解析
-
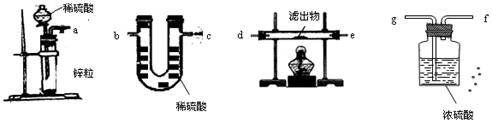
Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况),则下列说法不正确的是
A.Cu2O跟稀硝酸反应的化学方程式为: 3Cu2O+14HNO3==6Cu(NO3)2 + 2NO↑+7H2O
B.如混合物中Cu的物质的量为X,X的取值范围0.005mol <X<0.015mol
C.如混合物中含0.01moLCu,则n(Cu2O)=0.005mol,n(CuO)=0.005mol
D.产物中硝酸铜的物质的量为0.015mol
难度: 简单查看答案及解析
-
某溶液中只可能含有下列离子中的几种:K+ 、NH4+ 、NO3- 、SO42- 、SO32- 、CO32-,取200mL该溶液分成两等份,进行以下实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。
(2)第二份先加足量的盐酸无现象,再加足量的BaCl2,得到2.33g固体,则该溶液中( )
A.可能含有K+ 、CO32- B.肯定含有NO3- 、SO42- 、NH4+
C.一定不含有NO3- D.一定含有K+且c(K+)≥0.1mol/L
难度: 简单查看答案及解析
-
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
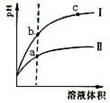
A.Ⅱ为盐酸稀释时pH变化曲线
B.a点KW的数值比c点KW的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
难度: 简单查看答案及解析
-
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
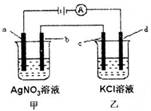
A.甲、乙两烧杯中溶液的pH均升高
B.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
C.乙烧杯中c的电极反应式为2Cl--2e-=Cl2↑
D.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀
难度: 简单查看答案及解析
-
(16分).有机物X、A、B、C、D、E、F、G、H可以发生如下转化。其中C苯环上的一氯代物只有两种,烯烃H与HCl加成生成的产物有两种,D分子中所有的原子不可能均处在同一平面内。
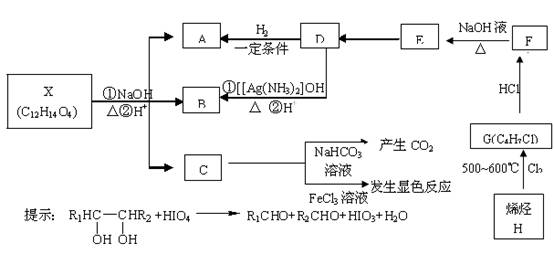
回答下列问题:
(1)C中含氧官能团的名称____________;
(2)写出下列物质的结构简式:
D____________、X____________;
(3)写出下列化学反应方程式及反应类型
①H
G:____________;反应类型:______
②F
E:____________;反应类型:______
(4)C的另一种同分异构体甲满足以下条件:
①属于芳香族化合物;②苯环上的一氯取代物只有一种;③与足量的NaOH溶液完全反应1 mol甲消耗3 mol NaOH。写出甲所有的结构简式:_________________。
难度: 简单查看答案及解析