-
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
A.家中发生天然气泄漏,不能在室内用电话报警
B.洁厕剂和漂白精不能混合使用,否则易产生有毒气体
C.双氧水可用于杀菌、消毒、漂白
D.明矾既可用于净水,又可杀菌消毒
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法正确的是
A.14g C2H4和C4H8的混合气体中所含的共价键数为 3NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C.24g 3H218O含有的中子数为12NA
D.0.1 mol O22-所含的电子数为1.6NA
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.电解氯化镁溶液:2Cl¯ + 2H2O ═ 2OH¯ + H2↑+ Cl2↑
B.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO
C.将少量CO2气体通入苯酚钠溶液中:2C6H5O- + CO2 + H2O→2C6H5OH +CO32-
D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O
难度: 困难查看答案及解析
-
下列各组离子一定能大量共存的是
A.含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3-
B.加入Al有H2生成的溶液中:Na+、K+、Cl-、NO3-
C.NaOH溶液中:K+、Na+、AlO2-、CO32-
D.NaHCO3溶液中:K+、Al3+、Cl-、SO42-
难度: 中等查看答案及解析
-
25℃时,溶液只含有Na+、H+、OH-、CH3COO-这四种离子,下列说法错误的是
A.溶液只能是CH3COONa溶液
B.溶液中的离子浓度可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.溶液中的离子浓度可能是c(Na+)> c(CH3COO-)> c(OH-)>c(H+)
D.溶液中的离子浓度可能是c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
难度: 中等查看答案及解析
-
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计),则下列说法错误的是

A.常温下,MA的水溶液的pH=a,由水电离产生的c(H+)=1×10-a mol·L-1
B.在K点,水溶液中存在:c(M+) = 2c(A-)
C.在N点,水溶液中存在:c(M+) + c(H+)= c(A-)+ c(OH-)
D.在K点,若此时溶液的pH=10,则c(MOH)+c(M+)=0.01mol·L-1
难度: 困难查看答案及解析
-
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
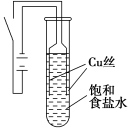
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质
氯化铜
氧化亚铜
氢氧化亚铜(不稳定)
氯化亚铜
颜色
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色
红色
橙黄色
白色
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e¯ ═ H2↑+ 2OH¯
C.电解过程中氯离子移向阳极
D.试管底部红色的固体具有还原性
难度: 困难查看答案及解析