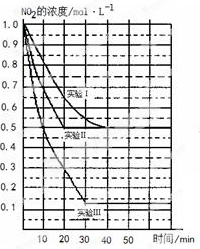
-
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘131和铯137(
)向外界泄漏。下列相关说法正确的是
A.每个
离子中有83个中子 B.CsOH的碱性比KOH弱
C.HIO4是碘的最高价氧化物的水化物 D.HF溶液比HI溶液的酸性强
难度: 简单查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法正确的是
A.1molAl3+离子含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.标准状况时1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式:
B.O2-的结构示意图:
C.二氧化硅的分子式:SiO2
D.质子数为8,中子数为10的氧原子:
难度: 简单查看答案及解析
-
下列说法正确的是
A.氢键、分子间作用力、离子键、共价键都是微粒间的作用力。其中分子间作用力只影响物质的熔沸点而不影响物质的溶解性。
B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向。
C.H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象。
D.原子结构模型的演变经历了:
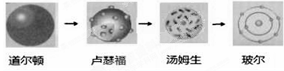
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
B.遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+
C.与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3-
D.加入NaOH后加热既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO--
难度: 简单查看答案及解析
-
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
①中的物质
②中的物质
预测①的现象
A
淀粉KI溶液
浓硝酸
无明显变化
B
酚酞溶液
浓盐酸
无明显变化
C
AlCl3溶液
浓氨水
有白色沉淀
D
湿润红纸条
饱和氯水
红纸条褪色]
难度: 简单查看答案及解析
-
亚氨基锂(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
难度: 简单查看答案及解析
-
下列叙述正确的是
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:
2ClO-+CO2+ H2O =2HClO+CO32-
C.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
D.等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2+ + 2OH- + NH4+ + HCO3- = BaCO3↓ + NH3•H2O + H2O
难度: 简单查看答案及解析
-
下列实验方案正确且能达到相应实验预期目的的是
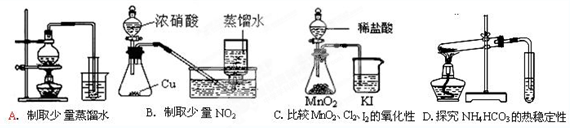
难度: 简单查看答案及解析
-
a、b、c、都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族。c原子核内质子数等于a、b原子核内质子数之和,c原子最外层上的电子数是d原子最外层电子数的4倍。下列说法中正确的
A.a、c两元素处在元素周期表的VIA族
B.b、c、d三种元素可组成化学式为dcb2的化合物
C.d单质在b单质中燃烧生成的化合物中阴阳离子个数比为1︰2
D.c的单质可用来制作光导纤维
难度: 简单查看答案及解析
-
某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3-五种离子。若向其中加入Na2O2粉末,充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.NO3- B.CO32-、NO3- C.SO32-、NO3- D.CO32-、NO3-、Na+
难度: 简单查看答案及解析
-
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是

A.若W是强氧化性的单质,则X可能是金属铝
B.若W是氢氧化钠,则X水溶液为酸性
C.若W是单质铁,则Z溶液可能是FeCl2溶液
D.若W是氧气,则X、Z的相对分子质量可能相差14
难度: 简单查看答案及解析
-
已知101 k Pa时辛烷的燃烧热为-5518 kJ· mol-1。则下列热化学方程式书写正确的是
A.2C8H18 + 25O2 = 16CO2 + 18H2O △H =-11036 kJ·mol-1
B.2C8H18(l) + 25O2(g) = 16CO2(g) + 18H2O(l) △H =-11036 kJ·mol-1
C.2C8H18(l) + 25O2(g) = 16CO2(g) + 18H2O(g) △H =-11036 kJ·mol-1
D.2C8H18(l) + 25O2(g) = 16CO2(g))+18H2O(l) △H =-5518kJ·mol-1
难度: 简单查看答案及解析
-
下列说法正确的是
A.碳和SiO2反应能置换出硅,说明碳的非金属性比硅强
B.SO2通入碘水中,碘水褪色,反应的离子方程式为SO2+I2+2H2O=SO42-+2HI+2H+
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.已知I3-
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 简单查看答案及解析
-
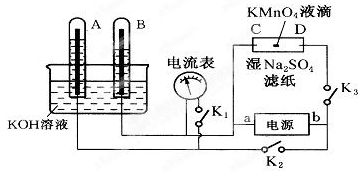
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,其中下列说法不合理的是
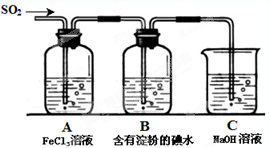
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
难度: 简单查看答案及解析