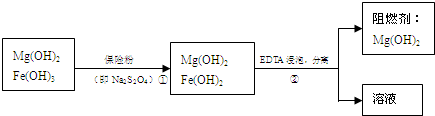
-
化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点难度: 中等查看答案及解析
-
某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤SO42-、⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )步骤 操作 现象 1 用pH试纸检验 溶液的pH大于7 2 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙色 3 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 4 过滤,向滤液中加入AgNO3溶液 有白色沉淀产生
A.肯定含有的离子是①④⑥
B.不能确定的离子是①
C.肯定没有的离子是②⑤
D.不能确定的离子是③⑤难度: 中等查看答案及解析
-
下列关于环境、健康和发展的叙述中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应”
C.一些有效成分为碳酸钙的补钙剂需嚼烂服用,目的在于加快消化吸收
D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀难度: 中等查看答案及解析
-
往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生.下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强难度: 中等查看答案及解析
-
高温下,反应CO2+H2
CO+H2O 达到平衡.下列说法正确的是( )
A.恒容时,温度升高,H2浓度减小,该反应是焓变为正值
B.恒容时,温度升高,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小
D.增加催化剂的质量,CO2的转化率升高难度: 中等查看答案及解析
-
判断下列有关化学基本概念的依据正确的是( )
A.氧化还原反应:元素的化合价是否变化
B.胶体:物质的微粒直径是否在1 nm~100 nm之间
C.共价化合物:组成物质的元素是否全部是非金属元素
D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象难度: 中等查看答案及解析
-
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是( )
A.I2在反应①中是还原产物,在反应②中是氧化产物
B.两个反应中生成等量的I2时转移的电子数相等
C.NaI和NaIO3在一定条件下能反应生成I2
D.NaIO3 在化学反应中只能做氧化剂不能做还原剂难度: 中等查看答案及解析