-
化学与社会、科学、技术、环境、生活等有密切关系,下列说法正确的是
A. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
B. 合成洗涤剂和纯碱溶液都可洗去油污的原理相同
C. 纤维素食用后在人体内水解为葡萄糖为人体提供能量
D. SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A. 丙烷的球棍模型:

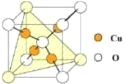
B. CO2的比例模型:

C. 氢氧化钠的电子式:
D. 次氯酸的结构式:H-Cl-O
难度: 简单查看答案及解析
-
下列有关物质分离说法正确的是
A. 乙酸乙酯与乙醇的分离可用分液操作
B. 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水
C. 碘洒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色
D. 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是
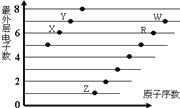
A. 元素的非金属性: X>R>W
B. 简单离子的半径:W>R>X
C. X与W形成的化合物中只有共价键
D. X与Z形成的化合物中只有离子键
难度: 中等查看答案及解析
-
已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为
C. 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 9 g超重水(3H216O)含中子数为6NA
B. 0.1 molH2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
C. 1 L 0.1 mol·L-1的NaHCO3溶液中
和
离子数之和为0.1 NA
D. 235g核素
发生裂变反应:
净产生的中子(
)数为10NA
难度: 困难查看答案及解析
-
25℃时,向50mL 0.018mol/L
溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知:
,则生成沉淀后的体系中
为(忽略溶液体积变化)
A.
mol/L B.
mol/L
C.
mol/L D.
mol/L
难度: 中等查看答案及解析
-
将1000 mL 0.1 mol·L-1BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1000 mL 0.5 mol·L-1HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为
A. (5a-2b) kJ B. (2b-5a) kJ
C. (5a+2b) kJ D. (10a+4b) kJ
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A.
向2 mL 0.1
的
溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3分解产生了氨气
D.
漂白粉在空气中久置
变成块状固体
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式表达正确的是
A. FeC13溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2
B. 1mol·L-1NaA102溶液和4 mol·L-1HCl溶液等体积混合:AlO2-+4H+=Al3++2H2O
C. NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O
D. Na2S2O3溶液中滴加过量稀H2SO4: 3S2O32-+2H+=4S↓+2SO42-+H2O
难度: 困难查看答案及解析
-
某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A. 肯定不含I- B. 肯定含有SO32-、I-
C. 肯定不含SO42- D. 肯定含有NH4+
难度: 困难查看答案及解析
-
萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
A. a和b都属于芳香族化合物
B. a、b和c均能使酸性KMnO4溶液褪色
C. a和c分子中所有碳原子均处于同一平面上
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置,则下列说法正确的是
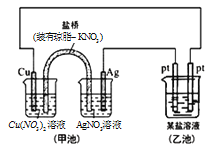
A. 图中甲池为原电池装置,Cu电极发生还原反应
B. 实验过程中,甲池左侧烧杯中
的浓度不变
C. 若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
D. 若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
难度: 困难查看答案及解析
-
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
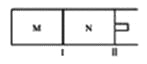
A. 若x=3,达到平衡后A的体积分数关系为:
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
难度: 困难查看答案及解析
-
常温下,不考虑混合后溶液体积的变化,下列说法错误的是
A. 0.1mol·L-1CH3COOH溶液加水稀释后,溶液中
的值增大
B. pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1%
C. amol·L-1H2C2O4溶液与2amol·L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-)
D. 0.1mol·L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③
难度: 困难查看答案及解析
-
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.225mol/L B. 0.30mol/L C. 0.36mol/L D. 0.45mol/L
难度: 简单查看答案及解析