-
下列做法不能体现低碳生活的是
A.减少食物加工过程 B.注意节约用电
C.尽量购买本地的、当季的食物 D.大量使用薪柴为燃料
难度: 简单查看答案及解析
-
下列有关物质结构的表述正确的是
A.次氯酸的电子式
B.二氧化硅的分子式 SiO2
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图
难度: 中等查看答案及解析
-
下列有机物命名正确的是
A.
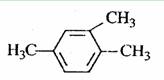 1,3,4-三甲苯
1,3,4-三甲苯B.
2-甲基-2-氯丙烷
C.
2-甲基-1-丙醇
D.
2-甲基-3-丁炔
难度: 中等查看答案及解析
-
下列有关物质性质的描述不符合事实的是
A.有机物不导电 B.金刚石是自然界最硬的物质
C.SO2可用作食品防腐剂 D.NO可用于某些疾病的治疗
难度: 中等查看答案及解析
-
下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
难度: 中等查看答案及解析
-
正确的实验操作是实验成功的重要因素,下列实验操作错误的是
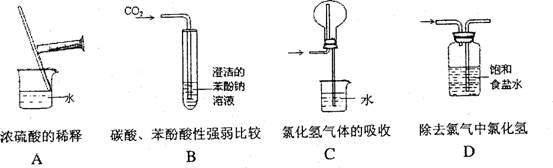
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L戊烷所含分子数为0.1 NA
难度: 中等查看答案及解析
-
下列实验目的可以达到的是
A.电解熔融氯化镁制取金属镁
B.醋酸钠结晶水合物与碱石灰共热制取甲烷
C.浓硫酸与溴化钠共热制取溴化氢
D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+
难度: 中等查看答案及解析
-
下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、甲苯、硝基苯 B.苯、苯酚、己烯
C.苯、甲苯、环己烷 D.甲酸、乙醛、乙酸
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
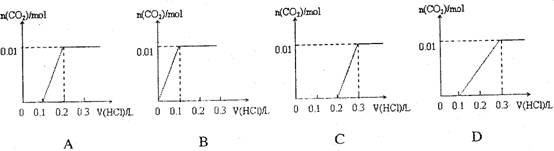
难度: 中等查看答案及解析
-
下列实验操作或实验事故处理正确的是
A.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中
B.实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸
C.实验时手指不小心沾上苯酚,立即用70o以上的热水清洗
D.实验室制乙酸丁酯时,用水浴加热
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH
D.1L 1 mol·L-1的碳酸钠溶液吸收SO2的量大于1L mol·L-1硫化钠溶液吸收SO2的量
难度: 中等查看答案及解析
-
除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
难度: 中等查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元酸和pH=12的一元强碱等体积混合: [OH-]= [H+]
C.0.1 mol·L-1的硫酸铵溶液中:[NH4+]>[SO42-]>[H+]
D.0.1 mol·L-1的硫化钠溶液中:[OH-]=[H+]+[HS-]+[H2S]
难度: 中等查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 中等查看答案及解析



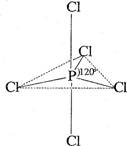 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。