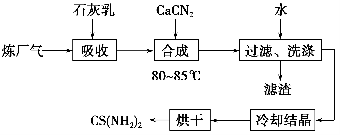
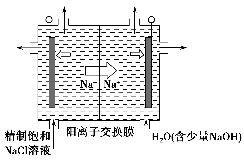
-
下列化学实验事实及其结论都正确的是 ( )。
选项 实验事实 结论
A 将SO2通入含HClO的溶液中生成H2SO4 HClO酸性比H2SO4强
B 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝
C SiO2可以与NaOH溶液及HF溶液反应 SiO2属于两性氧化物
D 将SO2通入溴水中,溴水褪色 SO2具有漂白性
难度: 中等查看答案及解析
-
下列化学物质在实际生产生活和科技等方面的应用不正确的是 ( )。
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
难度: 中等查看答案及解析
-
下列说法符合绿色化学思想的是 ( )。
A.对工业生产硝酸产生的废气、废水进行严格处理
B.利用根瘤菌固氮以减少氮肥生产厂
C.实验室制备NO2时在通风橱内进行
D.生产硫酸的工厂种草、种树,使其成为“花园式工厂”
难度: 中等查看答案及解析
-
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是 ( )。
选项 转化关系
A
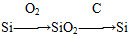
B
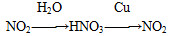
C
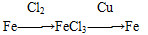
D

难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲
乙
丙。下列有关物质的推断不正确的是 ( )。
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )。
A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
难度: 中等查看答案及解析
-
下列说法正确的是 ( )。
A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
B.金刚石是自然界中硬度最大的物质,高温下可与氧气发生反应
C.浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
难度: 中等查看答案及解析
-
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是 ( )。

A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下)
难度: 中等查看答案及解析